CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
|
Post n°393 pubblicato il 26 Gennaio 2018 da paoloalbert
Non aspettatevi un granchè da questo post, nè tantomeno una cosa inedita; semplicemente è un esperimento talmente banale che l'ho sempre rimandato.
Ho cercato qualche giorno fa di reperire commercialmente i vecchi pennini, senza riuscirci.
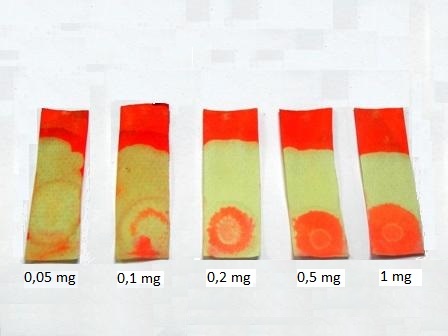
Il sale ferroso/ferrico impregna bene le fibre di cellulosa della carta e quindi è del tutto indelebile (ma devo farci un esperimentino... vedremo). |
|
Post n°392 pubblicato il 25 Dicembre 2017 da paoloalbert
|
|
Post n°391 pubblicato il 21 Dicembre 2017 da paoloalbert
Continua dalla volta scorsa.
Dopo aver spaccato pietre tutta la mattina come i forzati di Yuma, dopo esserci divertiti per l'esperienza e guardato ancora una volta l'infinito, siamo tornati a Novate Mezzola a prendere la 127 della famiglia media italiana e ce ne siamo tornati a casa più ricchi di quando siam partiti. |
|
Post n°390 pubblicato il 13 Dicembre 2017 da paoloalbert
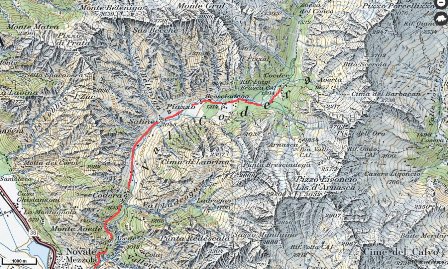
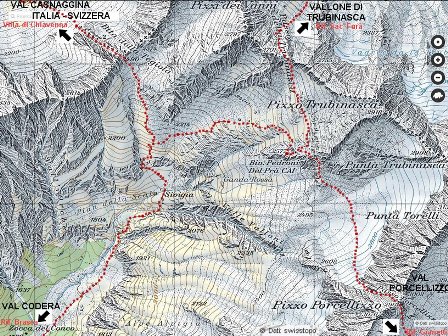
Eravamo venuti a sapere, io e il Danilo, giovani e studenti, che in alta Val Codera verso il Pizzo Trubinasca c'erano le pegmatiti. Prima parte del percorso: da Novate Mezzola al Rifugio Brasca
Seconda parte: dal Rifugio Brasca al Bivacco Vaninetti
Lasciamo la macchina vicino a Novate Mezzola in un pomeriggio caldissimo di luglio.
|
|
Post n°389 pubblicato il 22 Novembre 2017 da paoloalbert
Qualcuno avrà notato che amo paragonare gli elementi ai componenti di una numerosa compagnia teatrale nella quale ogni elemento, come ogni attore, ha il suo carattere e la parte da recitare.
Non che ci sia un granchè da vedere nei sali di berillio, sono per lo più tutti composti bianchi senza alcun appeal cromatico; tutti sono assai velenosi.
è estremamente leggero (1,85 g/cm3, una piuma) e con alto punto di fusione, 1287°. Ci sono in giro per il mondo miniere particolarmente curiose (ne ho già detto per il litio, il cesio e altro) ed il berillio me ne dà ancora lo spunto.
Le tecniche utilizzate dalla Brush Wellman Inc. per estrarre il minerale di berillio sono particolari perchè la mineralizzazione nel tufo è incolore e con struttura cristallina tanto piccola che non produce caratteristiche fisiche visibili che aiuterebbero a identificarla.
|
|
Post n°388 pubblicato il 16 Novembre 2017 da paoloalbert
A pochi passi da casa c'è questo piccolo caco che quest'anno ha preso i colori dell'autunno come non mai. |
|
Post n°387 pubblicato il 29 Ottobre 2017 da paoloalbert
Mi piacciono le piante in generale, figuriamoci se non amo qualsiasi vegetale che mi produce, gratis per sintesi interna, una interessante sostanza chimica con la sua bella formulaccia!
Della stevia si sa ormai, grazie a San Google, vita morte e miracoli: che è molto dolce, che arriva dal Paraguay, eccetera, eccetera, come al solito non mi soffermo su ciò. Per l'estrazione del principio attivo ho posto le foglioline secche ben sminuzzate in 250 ml di etanolo ed ho lasciato digerire per una decina di giorni in posto fresco, mescolando di quando in quando.
|
|
Post n°386 pubblicato il 21 Ottobre 2017 da paoloalbert
Chimica sperimentale, dove sei finita? |
|
Post n°385 pubblicato il 08 Ottobre 2017 da paoloalbert
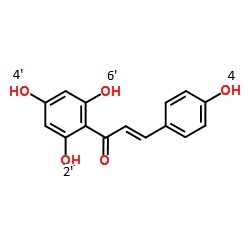
Chi legge non si aspetti un granchè di mistero: è un misterucolo da niente, ma dato che tutto è relativo può avere la sua importanza nel minicontesto di questo blog.
4,2',4',6'-tetraidrossicalcone |
|
Post n°384 pubblicato il 13 Settembre 2017 da paoloalbert
Più che sfortunata la definirei ingenua e temeraria, ma quelli erano i tempi e gli uomini e del resto tutte le prime grandi conquiste geografiche sono state assolutamente temerarie.
L'apparecchio per l'idrogeno e gli operai addetti |
|
Post n°383 pubblicato il 06 Settembre 2017 da paoloalbert
"Mancò la fortuna, non il valore", si dice per El Alamein. |
|
Post n°382 pubblicato il 27 Luglio 2017 da paoloalbert
Mando il mio blog in vacanza per un bel po' di tempo, per un buonissimo motivo!
|
|
Post n°381 pubblicato il 10 Luglio 2017 da paoloalbert
Ho visto qualche giorno fa in un mercatino dell'usato a prezzo irrisorio uno di quei radiatoroni da computer muniti di ventola per quei patiti della supervelocità o dei supergiga che più che radiatori da microprocessore sembrano pezzi di auto da corsa e sono anche esteticamente molto curati.
I due radiatori (freddo in alto, caldo in basso)
Vista di fronte, vaschetta vuota con il troppo pieno per l'acqua
Vista retro, la ventola a 12 V
La cella Peltier (linea bianca) stretta tra i due radiatori
|
|
Post n°380 pubblicato il 05 Luglio 2017 da paoloalbert
Mi è sempre piaciuto l'acido formico, per quel suo nome dal sapore alchimistico, che te lo fa immaginare come quintessenza di milioni di formiche distillate da un athanor.
Nella fotografia sembra una crostaccia ma in realtà sono tutti bei cristallini, molto solubili in acqua e di un sapore, se lo volete sapere, davvero davvero disgustoso. Un paio di formulette per qualche simpatizzante poco chimico che passasse di qui: se H-COOH è l'acido formico, il rame bivalente allunga le due braccine e acchiappa un formico (nel punto giusto) uno di qua e uno di là, così: |
|
Post n°379 pubblicato il 19 Giugno 2017 da paoloalbert
..e adesso assaggerete la Feniltiocarbammide e poi mi saprete dire...- |
|
Post n°378 pubblicato il 09 Giugno 2017 da paoloalbert
Mi scrive Sabrina, in uno di quei messaggi ai quali io ingenuamente sempre rispondo, ma che raramente hanno un controesito:
|
|
Post n°377 pubblicato il 22 Maggio 2017 da paoloalbert
E' il momento di mettere alla prova l'esanitrodifenilammina preparata per la ricerca microchimica del potassio; si tratta di un buon vecchio metodo storico e quindi, dal mio punto di vista, molto interessante. Qui si conclude la mia saga di questa famiglia, secondo questa genealogia: |
|
Post n°376 pubblicato il 11 Maggio 2017 da paoloalbert
Prima del test per il potassio con la dipicrilammina, ho voluto vedere, per pura curiosità, il bel sale insolubile di questo metallo alcalino.
Il sale di K precipita L'enorme potere colorante
[Durante questi esperimenti fare tantissima attenzione alle mani! Ved. commento nel post precedente!] L'esanitrodifenilammina forma sali insolubili e cristallini pure con parecchi altri metalli (Rb, Cs, Tl, Be, Zr, Pb, Hg), mentre forma precipitati amorfi con Al, Fe, Cr, Ni, Co, Cu, Bi, V, Ti, Th), ed ho fatto qualche prova estemporanea con qualcuno di essi senza qui renderne conto; anche perchè mi è oltremodo fastidioso aver a che fare con questa sostanza. Ricordo anche che il sale di ammonio della DPA è stato usato un tempo come bel colorante per lana e seta, col nome di Auranzia, e devo dire che in quanto a potere colorante è veramente potente; tuttavia non poteva avere successo per le sue caratteristiche di tossicità e l'Auranzia fu presto sostituita, sicuramente senza alcun rimpianto. (Non voglio nemmeno immaginare, per la mia ipersensibilità verso l'esanitrodifenilammina, di aver dovuto indossare in tempi autarchici un indumento colorato col "giallo auranzia...!!!). |
|
Post n°375 pubblicato il 30 Aprile 2017 da paoloalbert
Ecco l'ultimo prodotto della serie, la 2,2',4,4',6,6'-esanitrodifenilammina ovvero dipicrilammina, col suo bel nome storico come piace a me.
Durante le prime aggiunte la sostanza si scioglie e la miscela nitrante si colora in arancio marroncino, ma poi in seguito schiarisce e comincia a riprecipitare come solido giallo pallido.
La dipicrilammina si presenta come una polvere microcristallina giallina simile al tetranitroderivato di partenza, che tende un po' ad impaccarsi quando è umida ed asciuga più lentamente delle sostanze da cui deriva. Per il resto è del tutto stabile ed altre sue proprietà non sono qui di interesse.
L'ho quindi tenuta in maggioranza non ricristallizzata, ritenendola adeguata alle prove che mi riprometto di fare, e cioè l'analisi del potassio; un pizzico lo salificherò per vedere un bel sale rosso di questo metallo, uno dei rari insolubili. |
|
Post n°374 pubblicato il 23 Aprile 2017 da paoloalbert
Per gli appassionati di linguistica (ma chi mai capiterà qui? Probabilità uguale a lim 1/x per x che tende a infinito...) ecco un bell'esempio di linguaggio locale.
|





































Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58