CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
| « La viscida Muresside... ... | La leggerai da lassù » |
|
Post n°126 pubblicato il 31 Agosto 2011 da paoloalbert
Eccoci finalmente alla fase sperimentale del saggio della muresside: cosa ci serve?
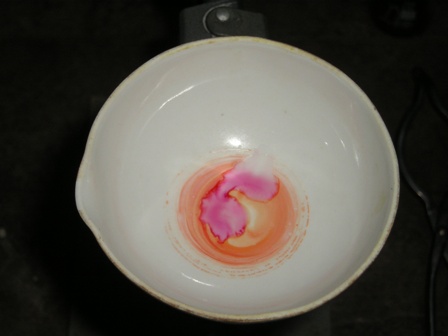
- porre in una capsula una piccola puntina di spatola di caffeina con circa 4-5 volte il suo peso di clorato di sodio o potassio, mescolare e ricoprire la miscela con un paio di ml di HCl concentrato.
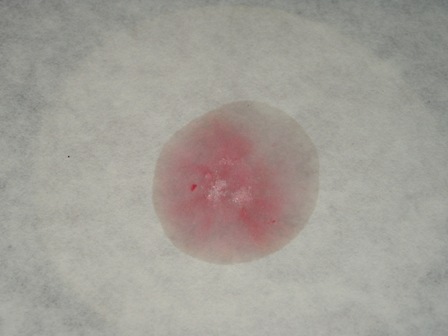
Test 2 - porre in una capsula una piccola puntina di spatola di caffeina e aggiungere 1 ml di HCl al 10% e 1 ml di acqua ossigenata al 30%.
Come si vede il test viene benissimo e la colorazione purpurea è molto evidente; chi non avesse a disposizione la caffeina potrebbe estrarne un po' dal tè (anche senza purificarla) e fare un test ancora più "ruspante" sul prodotto alimentare: oso sperare che qualche anonimo e incognito volontario prima o poi lo farà. |
https://blog.libero.it/paoloalbert/trackback.php?msg=10565164
I blog che hanno inviato un Trackback a questo messaggio:
|
|
MENU
ULTIMI COMMENTI
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58