CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
| « Sintesi del Cloruro di butirrile | La reazione di Borodin » |
|
Post n°9 pubblicato il 22 Gennaio 2010 da paoloalbert
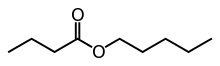
Questo post è in un certo senso la continuazione del precedente: mostra un impiego pratico del cloruro di butirrile per produrre il butirrato di amile. Questo è anche il fascino della chimica organica: si fa qualcosa per produrre qualcos'altro, e a sua volta questo qualcos'altro può generare un terzo derivato... Ho sintetizzato il butirrato di amile per sentire dal vivo l'aroma dell'"apricot oil", come è chiamato all'americana questo odoroso estere fruttato.
Un estere è il matrimonio tra un acido ed un alcool... eliminando una molecola d'acqua. Esempio pratico di quanto detto sopra: Radicale "etile" = CH3-CH2- Materiali occorrenti e procedura: - Cloruro di butirrile CH3-(CH2)2-CO-Cl In un pallone da 100 ml si introducono 16 g (18,5 ml) di alcool n-amilico ed a goccia a goccia agitando 15,5 g (15,3 ml) di butirrilcloruro. La soluzione tende a scaldarsi e ad ogni aggiunta si ha sviluppo di HCl gassoso fumante all'aria (lavorare sotto cappa o in ambiente adatto!). Terminata l'aggiunta del cloruro acilico, tenere in leggera agitazione ancora un po', e poi versare la soluzione in un imbuto separatore contenente 50 ml di acqua, agitare ed eliminare lo strato sottostante fortemente acido. Lavare un paio di volte con altri 50 ml di soluzione satura di NaHCO3 fino a neutralizzazione completa dell'acidità e poi ancora con acqua fino a reazione neutra. Essicare con qualche grammo di CaCl2 (io ho usato CuSO4 anidro). Non ho distillato in questo caso il prodotto perchè l'ho ritenuto sufficientemente puro per gli scopi che mi ero prefisso, ma per purificarlo ulteriormente andrebbe distillato raccogliendo ciò che passa a 183-186°. Amilbutirrato, d. 0,87, p.e. 185°. Resa 22 g (25 ml), circa l'80%. Reazioni CH3-(CH2)4-OH + CH3-(CH2)2-CO-Cl -->
Osservazioni |
https://blog.libero.it/paoloalbert/trackback.php?msg=8315091
I blog che hanno inviato un Trackback a questo messaggio:
MENU
ULTIMI COMMENTI
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58