CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Luglio 2011
|
Post n°120 pubblicato il 30 Luglio 2011 da paoloalbert
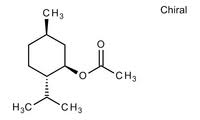
Non c'è niente da fare: ogni tanto il nostro "cuoco" si mette a fare una sana Fischer e poi ci propina l'estere con la scusa di farcene sentire l'olezzo... vabbè, andiamo allora a gustarci questo ennesimo sfizioso piattino: l'acetato di mentile!
Mi sono basato su una procedura eseguita da un bravo sperimentatore sporcaprovette anche lui e siccome questo estere aveva tre buone caratteristiche: 1)- è facile da fare ne ho volentieri sacrificato qualche grammo per sentire la differenza olfattiva tra il mentolo ed il suo derivato acetico.
Sistemare un refrigerante allhin e portare a lento riflusso per un paio di ore. |
|
Post n°119 pubblicato il 24 Luglio 2011 da paoloalbert
Eccoci finalmente alla Miniera di Monteneve, Val Ridanna, Sud Tirol.
Le opere di trasporto del minerale dalla zona di scavo hanno semplicemente dell'incredibile e la mia descrizione non ne renderebbe minimamente giustizia, quindi non la tento nemmeno. L'estensione delle gallerie, che si svolge su una infinità labirintica di livelli, è semplicemente pazzesca (circa 150 Km!), dei quali ovviamente pochissimi sono messi in sicurezza e visitabili, ma più che sufficienti a rendere un'idea esatta delle condizioni di vita e lavoro dei minatori in un posto simile. Ecco quello che sono riuscito a "scavare" dopo una gragnuola di martellate in uno gneiss compatto e durissimo: uno sputo di blenda/galena polverizzato, souvenir che mi son portato via per eseguirvi i test per l'argento, per soddisfare la mia solita curiosità chimica.
Alla fine della giornata, tra le varie considerazioni che si fanno in macchina al ritorno, a tutti noi è venuto spontaneo un interessante paragone sociologico, se così vogliamo chiamarlo. |
|
Post n°118 pubblicato il 21 Luglio 2011 da paoloalbert
Ecco un piccolo post interlocutorio... uno stacchetto insomma. Oggi sul bancone del mio lab batteva uno splendido raggio di sole, il cielo era terso e fuori soffiava un venticello che rendeva la vivibilità perfetta. Mi son detto che nel blog ogni tanto ci vuole un tocco chimico-artistico, magari una bella elio-fluorescenza, vista l'occasione...
Quello che si vede è una provetta bagnata con una soluzione molto diluita (circa 1%) di acido antranilico in glicerina e colpita dal famoso raggio di sole che fa venir subito sera.
Enjoy |
|
Post n°117 pubblicato il 15 Luglio 2011 da paoloalbert
Chimica ed Elettricità, recita il tema del Carnevale della Chimica, ospitato per questa settima edizione sul blog Storie di Scienza di Giovanni Boaga.
Il messaggio, per i pochissimi che non conoscessero il Morse, dice: Come si vede i caratteri sono ben visibili; la nitidezza lascia invece un po' a desiderare, ma la colpa è dei rudimentalissimi attrezzi di scrittura dei quali mi sono servito, visto che non avevo a disposizione una bella macchinetta ottocentesca in ottone. |
|
Post n°116 pubblicato il 11 Luglio 2011 da paoloalbert
Sfogliando il glorioso e prezioso Treadwell (ai suoi tempi aveva ancora le pagine rilegate in modo da doverle separare col tagliacarte!!!) mi è venuta l'idea di giocare un po' con una vecchia pila zinco-carbone che avevo e di preparare questo "ossido", che rappresenta una buona occasione per studiare un po' la chimica del manganese, non sempre conosciuta come si deve (almeno da me...).
4- Diluire la brodaglia nera con 500 ml di aqua mescolando bene e lasciar decantare pazientemente. Il carbone si separa (un po' galleggia, il resto va in basso).
Quando la soluzione ha riposato quanto basta, pipettare con attenzione il liquido, che deve risultare perfettamente limpido, senza traccia di carbone.
L'ossidazione è solo parziale ed aspettare che coinvolga tutta la massa sarebbe troppo lungo, allora...
9- Il manganito manganoso Mn2O3 (NON è l'ossido del manganese trivalente! E' Mn[MnO3] si presenta come una polvere marrone.
Notare che dopo pochi minuti il colore viola tende a virare a grigio e si ha precipitazione di fosfato di manganese "normale" Mn++ stabile. |






 Ho provato a replicare l'esperimento del nostro amico scozzese in maniera semplice ed estemporanea, tenendo ferma la carta e muovendo a mano il pennino:
Ho provato a replicare l'esperimento del nostro amico scozzese in maniera semplice ed estemporanea, tenendo ferma la carta e muovendo a mano il pennino:  Le foto mostrano la base di scrittura, costituita da un foglio di acciaio inox con la carta imbevuta del
Le foto mostrano la base di scrittura, costituita da un foglio di acciaio inox con la carta imbevuta del 
 2- La miscela elettrolitica è costituita da
2- La miscela elettrolitica è costituita da 
 6- Si nota infatti che il precipitato di
6- Si nota infatti che il precipitato di  8- Lasciar sedimentare anche stavolta (anzi più e più volte!) lavando ogni volta con 500 ml di acqua. Questa è la parte molto lunga e noiosa della procedura.
8- Lasciar sedimentare anche stavolta (anzi più e più volte!) lavando ogni volta con 500 ml di acqua. Questa è la parte molto lunga e noiosa della procedura.


Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58