CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Dicembre 2011
|
Post n°155 pubblicato il 28 Dicembre 2011 da paoloalbert
Uno dei libri della mia piccola biblioteca ai quali sono più affezionato (sono affezionato a tanti, in realtà!) è questo che si vede qui sotto in fotografia:
Anch'esso ha contribuito a quell'imprinting che ha mi inoculato fin da giovane il virus chimico nel DNA. Lo sdoppiamento della personalità è descritta in modo magistrale da Stevenson, con tutti gli ingredienti per rendere il racconto estremamente avvincente, inserito profondamente all'interno di quella ben definita società vittoriana già di per sè avvincente, almeno per chi scrive, per la sua abissale differenza tra di essa e la nostra mediterranea imprevedibilità. -...a blood-red liquor, which was highly pungent to the sense of smell and seemed to me to contain phosphorus and some volatile ether...- -...the crushed phial in the hand and the strong smell of kernels that hung upon the air...- |
|
Post n°154 pubblicato il 25 Dicembre 2011 da paoloalbert
|
|
Post n°153 pubblicato il 20 Dicembre 2011 da paoloalbert
Vero che sono sempre complicate e aggrovigliate le associazioni di idee?
Che è successo? Improvvisa fusione neuronica nel mio brain? Intossicazione acutissima da composti cianosolforati? No, molto più semplice, adesso spiego il motivo di tale strana associazione mentale che di solito mi viene in questo periodo. Ecco, ora tutto si spiega, vero?
Mettere la senape nella mostarda non è semplice, come diceva la buon'anima di mia nonna: ce ne deve andare la giusta quantità, nè troppo, chè altrimenti il prodotto rischia di diventare una brace ardente che ti leva il fiato, nè troppo poco perchè ciò porta ad una massa fruttosa solo dolce e inconcludente. Nei prodotti commerciali, pur buoni, (quelli del nostro pacco lo sono) trovo difficile riscontrare questo giusto equilibrio tra frutta e senape e noto ogni anno con stupore che talvolta si tende ad esagerare in maniera sciocca con l'isotiocianato, come se si volesse virtualmente assassinare l'ignaro consumatore togliendogli il respiro. Il vasetto dovette rimanere aperto (ben protetto, ma aperto) fino a inverno inoltrato per poter essere consumato, sfruttando la nota volatilità dei tiocianati alchilici; inutile dire che il titolare dell'azienda produttrice, da me gentilmente invitato a casa mia a mangiarsi un pezzetto del suo mandarino candito, non si è mai presentato... sicuramente sapendo a cosa andava incontro. Si dirà che forse sono io che sono troppo delicato! |
|
Post n°152 pubblicato il 16 Dicembre 2011 da paoloalbert
Ed eccoci finalmente al saggio completo del simpatico Sor Lasagna: dobbiamo trovare nel lab una sostanza che contenga tutti e tre insieme gli elementi "sensibili", cioè zolfo, azoto e alogeni, oltre naturalmente a carbonio, idrogeno e ossigeno tipici delle sostanze organiche.
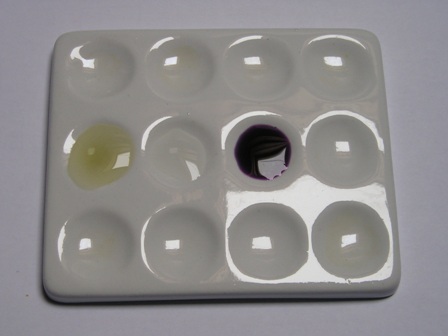
La foto mostra le tre soluzioni che ho messo nei pozzetti per questa prova: a sinistra la prova in bianco con acqua e nitroprussiato, al centro la soluzione di Lassaigne da sola e a destra l'aggiunta alla medesima del nitroprussiato.
Le foto mostrano la soluzione prima e dopo l'aggiunta di AgNO3: mi pare che non ci siano dubbi nemmeno questa volta, anche il cloro c'è! |
|
Post n°151 pubblicato il 12 Dicembre 2011 da paoloalbert
Questa prima "lasagnata" (ved. post precedente) l'ho fatta come prova dimostrativa per la rilevazione dell'azoto, pertanto non sarà una vera ricerca ma una conferma, dato che sono partito volutamente da una sostanza ben ricca in azoto (circa il 47%!) per rendere sicuramente evidenti i risultati. La sostanza azotata e il sod io Il tubetto pronto per la pirolisi Le foto mostrano questi preparativi "statici", mentre lascio alla fantasia di chi legge immaginare le fasi "dinamiche", ovvero l'arroventamento del tubetto sul bunsen e la sua "decisa" reazione quando lo si butta in acqua. Andiamo a verificare.
Aggiunta di solfato ferroso Messi in una beutina circa 15 ml (ne basterebbero molti meno) della soluzione prima ottenuta, aggiungere una puntina di spatola di FeSO4 e mescolare; nell'ambiente così basico si forma subito un precipitato gelatinoso grigio verdastro di composti ferrosi, ma si forma anche il complesso ferrocianuro sodico Na4[Fe(CN)6] solubile e incolore, quindi non visibile.
Aggiungere una goccia di acqua ossigenata (o anche insufflare dell'aria per un po' di tempo) per ossidare parzialmente a ferrico il solfato ferroso, in modo da avere in soluzione anche ioni -Fe3+.
Formazione di Fe4[Fe(CN)6]3 Il residuo di Blù di Prussia Le foto mostrano la filtrazione e l'abbondantissimo residuo di ferrocianuro ferrico rimasto sulla carta da filtro, conferma assai evidente (lo sapevamo già!) che il campione in oggetto conteneva azoto e quindi aveva generato NaCN. |
|
Post n°150 pubblicato il 08 Dicembre 2011 da paoloalbert
In chimica organica analitica (classica) il saggio di Lassaigne è una pietra miliare: con una procedura semplicissima permette di determinare se una sostanza ignota contiene zolfo, azoto o alogeni, singolarmente o anche tutti insieme.
- il solfuro di sodio viene riconosciuto ponendo nel pozzetto di una piastrina in porcellana una decina di gocce di soluzione e aggiungendo, senza mescolare, qualche cristallino di sodio nitroprussiato Na3[Fe(NO)(CN)5]. - il cianuro di sodio va evidenziato (previa eliminazione preliminare dello zolfo se era presente) in questo modo: - gli alogenuri di sodio (-Cl, -Br, I) vengono ricercati (anche qui previa eliminazione dello zolfo) acidificando qualche ml di soluzione con acido nitrico non in eccesso e aggiungendo una decina di gocce di nitrato d'argento AgNO3 0,1 M. |
|
Post n°149 pubblicato il 06 Dicembre 2011 da paoloalbert
Non è vero che ho proprio distrutto totalmente la storica radio a galena di mio padre fatta negli anni di guerra: ne ho ancora i pezzi fondamentali e volendo la potrei addirittura ricostruire quasi come in origine.
Non mi addentro volutamente in nessun particolare tecnico, ne ho già discusso anche troppo nella scorsa presentazione.
Cosa si sente con questa radio? E' vero che i servizi radio (in OM e OC) sono stati fortemente ridimensionati per motivi economici da quasi tutti i principali paesi, ma tra ridimensionare un servizio pubblico e distruggerlo la differenza è abissale. Tutto sufficiente, nel 1944, per sentire ogni sera le famose quattro note della quinta sinfonia di Beethoven, che suonano esattamente come la lettera V telegrafica del Morse, DI-DI-DI-DAAA... la famosa V di Victory. |
|
Post n°148 pubblicato il 04 Dicembre 2011 da paoloalbert
|


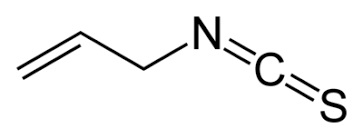
 Tutti sanno che nella vera mostarda, quella da intenditori, (quest'anno era quella mantovana) ci va la senape e la senape contiene appunto l'
Tutti sanno che nella vera mostarda, quella da intenditori, (quest'anno era quella mantovana) ci va la senape e la senape contiene appunto l'












 L'elemento chiave di questa radio è il
L'elemento chiave di questa radio è il  Dagli anni '50 in poi la galena è stata sostituita da un
Dagli anni '50 in poi la galena è stata sostituita da un
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58