CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Aprile 2012
|
Post n°174 pubblicato il 27 Aprile 2012 da paoloalbert
A Montevecchio ero riuscito fortunosamente a reperire, come si ricorderà, due "sassi" interessanti, gli unici fortemente mineralizzati che ero riuscito a trovare razzolando in una discarica difficilmente accessibile.
Devo dire che l'analisi ha completamente smentito le mie supposizioni: avevo ritenuto trattarsi di blenda... e invece di tutt'altro si tratta! Ma andiamo a procedere. Ho trattato 5 g di minerale, scegliendo la parte con meno ganga, con acido cloridrico concentrato a caldo, fino a dissoluzione quasi completa.
Precipitazione del cromato di piombo Il piombo infatti, se in piccola quantità, non rimane tutto come residuo insolubile del primo gruppo analitico ma passa in soluzione anche sotto forma del poco solubile PbCl2 e viene rivelato con sicurezza dal cromato.
Ferrocianuro ferrico (Blù di Prussia) Non metto le formule e le reazioni perchè sono banali e scontate; ecco le due foto finali, del tiocianato ferrico e del blù di Prussia, che dichiarano a gran voce che il minerale trovato NON era blenda ma un volgare (per modo di dire) minerale di ferro contaminato, diciamo così, da una discreta quantità di galena con associata pochissima blenda. |
|
Post n°173 pubblicato il 18 Aprile 2012 da paoloalbert
Se all'esame ti chiedessero: -"parlami della chimica del carbonio..." sicuramente non sapresti dove iniziare, perchè nella risposta ci sta tutto, e ancora di più. Preparazione dell' E questo è il cartellone dello spettacolo:
|
|
Post n°172 pubblicato il 13 Aprile 2012 da paoloalbert
Arrivare a due passi da una miniera senza vedere almeno un minerale utile di scavo è decisamente frustrante. |
|
Post n°171 pubblicato il 08 Aprile 2012 da paoloalbert
Dicevo l'altra volta che nel mio breve tour della Sardegna non avrei avuto quella mezza giornata a disposizione per cercare nella profumata macchia sarda la miniera di Zurufusu: infatti così è stato.
Ingurtosu, oggi
Resti di impianti e mineralizzazioni a blenda
Ruderi e discariche non mineralizzate
Ossidi di ferro nel Rio di Montevecchio
Fantasmi industriali lungo la strada Montevecchio-Ingurtosu
Alle dune di Piscinas: qui si imbarcava il minerale di piombo e zinco
|




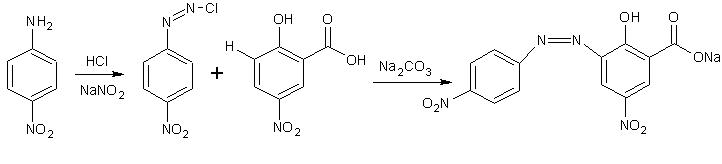
 Porre in una beuta da 100 ml 5 g di
Porre in una beuta da 100 ml 5 g di  Nel frattempo in un becker da 250 ml sciogliere 15 g di
Nel frattempo in un becker da 250 ml sciogliere 15 g di  Si forma prima un intorbidamento e poi un precipitato rosso scuro; lasciar riposare un paio di ore fino a reazione completa e poi portare a pH neutro con la giusta quantità di HCl.
Si forma prima un intorbidamento e poi un precipitato rosso scuro; lasciar riposare un paio di ore fino a reazione completa e poi portare a pH neutro con la giusta quantità di HCl.






Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58