CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Maggio 2012
|
Post n°180 pubblicato il 30 Maggio 2012 da paoloalbert
Segue dalla puntata precedente. I gr
Allontano a questo punto tutto il silicio per ebollizione prolungata a bagno maria e ottengo un concentrato con ancora molto HF in eccesso, nella soluzione più altobollente di 100°. Voglio tirare tutto a secco, come fare? Non potendo adoperare per ovvie ragioni oggetti in vetro (nè tantomeno crogiolini in platino!), preparo per l'occasione un piccolo evaporatore in teflon fresandone una cavità in un pezzetto di questo materiale; il teflon può essere riscaldato anche ad alta temperatura e resiste perfettamente all'acido fluoridrico.
Una volta arrivato a secchezza... sorpresa, ecco il risultato! Un bel po' di mg di residuo perfettamente gestibili, ma non di un bel colore azzurro come mi sarei maggiormente aspettato, bensì di un sospetto color ruggine.
Non sarà mica ferro anche stavolta! (ormai il ferro mi sta stufando quando salta fuori mentre mi aspetto altri elementi!).
Test con tiocianato - Test con ferrocianuro
Test con K etilxantato - Test con tracce di rame aggiunte
Conclusioni
Chissà quale prodotto cinese a base di ferro, forse ftalocianine o qualcosa di simile? |
|
Post n°179 pubblicato il 26 Maggio 2012 da paoloalbert
No, non mi è dato di volta il cervello (almeno non del tutto...), ma il discorso che segue è veramente dedicato a un gatto, quello della gentile Teresa (alla quale mi permetto invece di dedicare il quadro di Renoir...).
|
|
Post n°178 pubblicato il 18 Maggio 2012 da paoloalbert
Dopo un paio di post "storici", devo mantenere la promessa di mettere mano alla vetreria!
I componenti
Lo scopo di questo lavoro era verificare i parametri tensione/corrente della pila e quindi è indispensabile almeno un tester affidabile; ho usato il multimetro Schlumberger che si vede in seguito nelle immagini.
|
|
Post n°177 pubblicato il 14 Maggio 2012 da paoloalbert
Anche oggi un po' di storia... la prossima volta metto mano alla vetreria, promesso!
Monsieur Eugene Grenet per la verità ha fatto un po' troppo il furbo, perchè è dal 1856 che si prende tutto il merito per aver dato il nome a questa pila, che in realtà era stata inventata già quattordici anni prima da Johann Christian Poggendorff; lui l'ha resa solo un po' più pratica, prendendosi pure un brevetto tre anni più tardi. Questa pila, come quella di Volta, è un generatore ad un solo conduttore di seconda classe, cioè di una pila in cui la soluzione elettrolitica è una sola (conduttori di prima classe sono gli elettrodi metallici, di seconda la soluzione ionica). Grenet sostituì questo composto, scomodo da ottenere puro, con una soluzione solforica di bicromato di potassio K2Cr2O7, che è poi la stessa cosa (l'anidride cromica si ottiene per azione dell'H2SO4 sul bicromato; è la separazione successiva della CrO3 pura che è difficile). Ecco spiegato come gli elettrodi di carbone non partecipino alla reazione (non si consumano), mentre la povera lamina di zinco deve ossidarsi prendendosi sulle spalle metà del lavoro e sciogliendosi lentamente nella soluzione come solfato di zinco ZnSO4. La disposizione degli elettrodi, molto vicini e di grande superficie, unita al tipo di elettrolita, conferisce alla pila una resistenza interna particolarmente bassa e la rende quindi idonea ad erogare correnti molto intense, anche se per poco tempo. Per quanto affidabili e capaci di produrre un'intensa corrente, le pile al bicromato sono andate in disuso verso la fine del XIX secolo perché tendevano a "scaricarsi" troppo velocemente, anche se lo zinco veniva inserito soltanto quando si voleva alimentare il circuito utilizzatore.
|
|
Post n°176 pubblicato il 08 Maggio 2012 da paoloalbert
L'amico Marco mi ha recentemente invitato ad assistere ad una bella (quanto inconsueta!) conferenza sulla "Breve storia delle lampade da minatore"... ghiotta occasione alla quale ho dovuto con rammarico rinunciare.
---°°°OOO°°°--- |
|
Post n°175 pubblicato il 04 Maggio 2012 da paoloalbert
Oggi niente divagazioni storico-personali: lo chef ci schiaffa in tavola un piatto di sola chimicaccia per palati allenati. Ogni tanto una portata pesante rende più gradevoli le successive...
Materiale occorrente:
Il 1-naftalensulfonato sodico si presenta sotto forma di polvere microcritallina leggera che tende a impaccarsi di colore appena appena beige; non deve odorare per niente di naftalina. |
















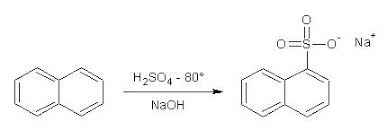
 Il naftalene tende a sublimare facilmente e nelle zone fredde del pallone si formerà uno straterello di sostanza sublimata, che non parteciperà alla reazione.
Il naftalene tende a sublimare facilmente e nelle zone fredde del pallone si formerà uno straterello di sostanza sublimata, che non parteciperà alla reazione.  In ogni caso filtrare, ottenendo una soluzione solo leggermente opalescente.
In ogni caso filtrare, ottenendo una soluzione solo leggermente opalescente.  Scaldare fino a circa 80° eventualmente continuando ad aggiungere NaCl alla soluzione che a caldo rimane leggermente rosata ma quasi limpida.
Scaldare fino a circa 80° eventualmente continuando ad aggiungere NaCl alla soluzione che a caldo rimane leggermente rosata ma quasi limpida. 
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58