CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Novembre 2012
|
Post n°208 pubblicato il 29 Novembre 2012 da paoloalbert
Non di sole sintesi vive l'uomo... e così talvolta mi soffermo a commentare a modo mio qualche libro che leggo. E' notevole, e lo dico a merito della Christie, che la scontatissima parola "cicuta" (hemlock) non viene nemmeno menzionata nel romanzo, ma sempre si cita il suo alcaloide principale, la coniina appunto.
[Apro una parentesi: sono convintissimo che questa scelta nell'uso dei termini, del tutto irrilevante per l'economia del romanzo, derivi dalla mentalità molto più "scientifica" del mondo anglosassone rispetto alla nostra; un criminale di un qualsiasi autore italiano MAI avrebbe adoperato la coniina (come parola) per avvelenare, ma semmai l'estratto di cicuta, o quant'altro...
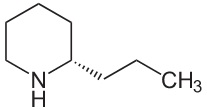
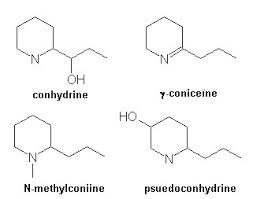
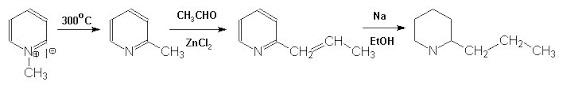
Tutti sono derivati della piperidina... vi ricordate? E' una delle famose "Gemelle PI". La sintesi fu fatta nel 1886 da Albert Lademburg, neanche a farlo apposta uno degi innumerevoli figli di quella eccezionale generatrice di chimici che fu la scuola tedesca della seconda metà del XIX° secolo. Separandone poi per cristallizzazione frazionata il tartrato ottenne gli enantiomeri, e quindi un prodotto identico a quello naturale.
Bravo Albert, il primo che taglia il traguardo passa alla storia! La (+)Coniina è un liquido con p.e. 166° con un indice di tossicità LD50 di circa 7mg/Kg, quindi MOLTO velenosa; l'azione è curaro-simile, cioè paralizzante muscolare, ed è in questo modo che il nostro personaggio... - [omissis] - ha ammazzato il pittore Amyas Crale nel giallo di Agatha Christie che mi è servito di spunto per questo discorso. |
|
Post n°207 pubblicato il 19 Novembre 2012 da paoloalbert
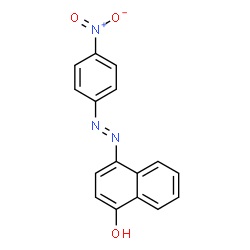
Qualche tempo fa avevo preparato il p-nitrobenzen-azo-1-naftolo, ovvero il Magneson II; oggi è il momento di verificare con delle semplici prove se questa sostanza (non l'avevo mai usata prima!) è proprio degna di questo nome e se sa fare il suo dovere, cioè essere MOLTO sensibile al magnesio.
La provetta (a sinistra) assume subito un colore azzurro che si va velocemente intensificando; dopo pochi minuti si vanno formando evidenti fiocchi di un precipitato blù, indice della presenza di ioni magnesio.
Non ho trovato in bibliografia l'effettiva sensibilità (in ppm di Mg2+) di questa reazione; tuttavia è sensibilissima, potendo rilevare tracce di magnesio. |
|
Post n°206 pubblicato il 13 Novembre 2012 da paoloalbert
Prima di mettere alla prova dell'acqua il p-nitrobenzen-azo-1-naftolo, ho dato un'occhiata ad uno di quegli impagabili libri degli anni '50 che ho la fortuna di possedere: la "Guida all'analisi qualitativa" (1953) del professor Umberto Sborgi.
Probabilmente mi è così caro anche per l'assenza di questi "artistici" particolari.
|
|
Post n°205 pubblicato il 09 Novembre 2012 da paoloalbert
In chimica analitica (quella classica) mi è sempre piaciuto il connubio Inorganica-Organica, cioè l'uso di reagenti organici per la rilevazione di un catione o di un anione. ---°°°OOO°°°--- Scorrendo per l'ennesima volta quella bibbia dell'organica sperimentale che è il Vogel, mi è capitata sottomano la sintesi del Magneson II, che mi sono affrettato a provare proprio per il motivo spiegato all'inizio.
Materiali occorrenti [Non ho foto della sintesi questa volta] In un becher da 100 ml sciogliere 2 g di p-nitroanilina in una miscela di 5,5 ml di HCl conc. + 5,5 ml di acqua, scaldando leggermente. Alla fine, aggiungere allo stesso modo dell'HCl conc. fino ad acidità decisa.
|
|
Post n°204 pubblicato il 06 Novembre 2012 da paoloalbert
In autunno o in inverno, forse perchè sono le stagioni che più odorano di spirito contemplativo, metto sempre qualche foto dell'ambiente che mi circonda.
Li si sente spesso d'estate che sgranano lunghe mitragliate di -ta-ta-ta-ta-ta-ta-ta-ta- soprattutto sulla corteccia dei castagni vuoti, a produrre quel bel buco che si vede nella foto tra le fronde.
|









Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58