CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Marzo 2013
|
Post n°228 pubblicato il 29 Marzo 2013 da paoloalbert
Mi sa che per trovare il Salofene in bottiglia oggi bisogna andare a Istanbul, o giù di lì.
Vecchi residui dei primi del novecento, messi in vetrina giusto per attirare l'attenzione di qualcuno come me.
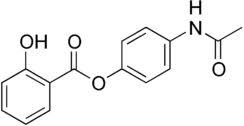
è più interessante: è un famoso medicinale della Bayer commercializzato a cavallo tra l'ottocento e il novecento, con azione antireumatica, antipiretica e antinevralgica. Infatti la molecola contiene sia l'acido salicilico che il paracetamolo, i quali si formano nell'intestino dopo l'assunzione. |
|
Post n°227 pubblicato il 22 Marzo 2013 da paoloalbert
Conservo gelosamente delle vecchissime riviste di mio padre degli anni '50, molto diffuse in quegli anni: Sistema Pratico, Sistema "a", e tante altre che ho trovato e acquisito anch'io molto più tardi. Si mescolino, in una provetta ben asciutta e pulita, mezzo cucchiaio di zolfo e mezzo di nitrato di potassio; riscaldate con molta prudenza il miscuglio, fino a che non si sprigionino dalla provetta vapori biancastri; a questo punto si aggiunga goccia a goccia una certa quantità di acqua: il liquido ottenuto risulterà acido solforico purissimo"- Lo facciamo l'esperimentino? Meglio di no, caro e simpaticissimo sig. Maurizio... il risultato ce lo immaginiamo perfettamente, soprattutto la "purezza" di quell'acido solforico di risulta... ma tant'è, siamo nel '59, l'ottimismo evidentemente dilagava anche nella chimica casalinga! |
|
Post n°226 pubblicato il 18 Marzo 2013 da paoloalbert
Riprendo il discorso sui minerali organici.
Si è formata probabilmente da una decomposizione lentissima di carbone a bassa temperatura.
Come esempi, riporto solo tre ossalati di calcio, rispettivamente mono, di e triidrato: la Whewellite Ca(C2O4)·H2O); la Weddellite Ca(C2O4)·2H2O (il nome deriva dal mar antartico di Weddell) e la Caoxite Ca[C2O4]·3H2O, trovata anche da noi in Liguria.
La Minguzzite si è formata dalla decomposizione di limonite di Capo Calamita nell'isola d'Elba. Scoperta nel 1955, è stata chiamata così in onore di Carlo Minguzzi, un mineralogista italiano dell'Università di Padova. Non è chiaro il suo processo di formazione.
La Dashkovaite a livello mondiale sembra esistere solo in una sperduta località siberiana.
Anche questa estremamente rara, è stata trovata in depositi boriferi idrotermali, sempre in Siberia.
Il minerale, molto organico per così dire, è stato trovato nel 1969 solo in una formazione sedimentaria nello stato dello Utah. Prende il nome in onore del grande geochimico americano P.Abelson.
Si forma, assieme ad altri sali ammonici, nel guano di uccelli marini nell'Isola di Guanape, in Perù.
Trovata nei giacimenti d'oro di Tuva, in Russia e nel deposito di rame di Blyava negli Urali.
Gli acetati come minerali naturali sono rari (soprattutto perchè solubili); si è trovata Hoganite nei pressi della infernale miniera di Potosì, in Bolivia. Dico infernale perchè ho visto un eccezionale documentario sulla vita in questa miniera... cose che non si dimenticano. Qui l'Hoganite si è formata accanto Paceite (Cu+Ca) nei depositi di minerale per alterazione con materiale vegetale in decomposizione. E quindi in definitiva un minerale semi-antropico.
Questa che segue la aggiungo solo per il suo simpatico e impronunciabile nome: Zhemchuzhnikovite NaMg(Al,Fe)(C2O4)3·8H2O, Kazakhstan!
|
|
Post n°225 pubblicato il 12 Marzo 2013 da paoloalbert
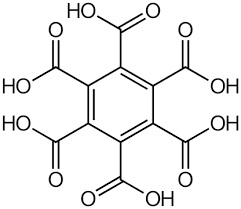
La prendo alla larga: una delle mie sintesi utopiche è da tempo quella di preparare l'acido mellitico o acido benzenesacarbossilico (ho ancora da qualche parte tutta la procedura); ma so già che non la farò mai... terribilmente lungo e dispendioso il procedimento e troppo aleatorio il risultato.
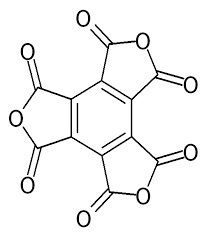
(a) Acido Mellitico e (b) Anidride mellitica
Questo acido mi ha sempre intrigato per due motivi: - primo perchè ha una bellissima formula, un benzene interamente circondato da sei gruppi carbossilici; Ne ho radunati un po' secondo una sequenza puramente indicativa e che non segue un ordine nè chimico nè mineralogico, li metterò semplicemente così come mi vengono.
E' il sale di alluminio dell'acido di cui sopra, il benzenesacarbossilico o acido mellitico, Al2C6(COO)6•16H2O Bello anche il seguente minerale: la Julienite, che è un tiocianato di sodio e cobalto Na2Co(SCN)4•8H2O
Come località tipo si trova nei dintorni di Chamibumba, in una provincia congolese del Katanga. |
|
Post n°224 pubblicato il 05 Marzo 2013 da paoloalbert
Dicono che Van Googh non avrebbe mai potuto dipingere i suoi girasoli senza il Giallo di Cadmio.
Ho ottenuto alla fine 7,9 g di metallo, pari a circa il 68% di resa; non mi aspettavo di più, considerando che ho scartato il CuS inglobante parecchia soluzione, i vari passaggi e che il materiale di partenza sicuramente non è CdS puro, ma solo un pigmento commerciale.
Ecco il cadmio polvere |
















Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58