CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
|
Post n°413 pubblicato il 06 Ottobre 2018 da paoloalbert
Riprendendo dalla volta scorsa... "-quella mia polveraccia scura avrà la bella forza di ossidare il Mn2+ a MnO4- ?"-
|
|
Post n°412 pubblicato il 26 Settembre 2018 da paoloalbert
Nel precedente articolo sullo xeroformio (tribromofenato di bismuto), accennavo al futuro tentativo di preparare una minima quantità di quell'interessante composto analitico, o meglio ex analitico, che è il bismutato di sodio, NaBiO3.
Il precipitato bruno (sempre bruno) risultante è decantato, filtrato e ancora lavato con NaOH al 50%.
|
|
Post n°411 pubblicato il 19 Settembre 2018 da paoloalbert
Ahi, ahi, povero blog, ti ho semiabbandonato! |
|
Post n°410 pubblicato il 11 Agosto 2018 da paoloalbert
|
|
Post n°409 pubblicato il 23 Luglio 2018 da paoloalbert
Sono andato qualche tempo fa, per curiosità, a vedere quel colossale mercatino dell'antiquariato che si svolge l'ultima domenica del mese a Piazzola sul Brenta.
L'ossido di bismuto così prodotto può essere usato per produrre qualche sale di questo metallo; esso si scioglie perfettamente in HCl formando BiCl3, il quale è stabile in ambiente cloridrico ma precipita immediatamente per diluizione come ossicloruro, BiOCl.
con il diabolico fascino dell'elemento trentatre... |
|
Post n°408 pubblicato il 21 Giugno 2018 da paoloalbert
L'Aconitum napellus non è certo una pianticella comune, ma ha una interessante particolarità: è la più velenosa della nostra flora.
Va bene qualche pianticella, ma mai viste così tante, fra erbacce e lamponi selvatici!
Avrei voluto soffermarmi e fare qualche foto decente e ravvicinata ai begli elmetti azzurri, ma non ne ho avuto la possibilità... sarà per la prossima volta.
|
|
Post n°407 pubblicato il 02 Giugno 2018 da paoloalbert
Ma cosa sono l'Ondina e Coltano? Riguarderà roba vecchia di sicuro, dirà qualcuno che capita non per la prima volta su questo blog. L'Ondina in pratica è una anonima bruttina scatolotta di legno scuro, con qualche milliamperometro e qualche manopola sul frontale, un oggetto che "se non se ne conosce la storia" non fa certo soffermare un frettoloso visitatore del bel museo.
[A proposito del Museo: encomiabile l'iniziativa della Marina Militare di renderne praticamente gratuita la visita, devolvendo la simbolica cifra di un euro e mezzo all'Istituto Doria che fornisce assistenza ai figli dei marinai caduti].
Un altro cimelio storico nazionale lasciato da decenni in totale abbandono, del quale si continua a parlare di "recupero" ma che alla data di questo post la palazzina Marconi si trovava come si vede in questa tristissima foto.
Essendo abituato da una vita "ad andare un po' in giro" anche fuori d'Italia, mi rammarico ancora di più perchè vedo com'è trattato e custodito il patrimonio storico-culturale in tanti altri Paesi, che ne fanno giusto orgoglio nazionale ed anche fonte di entrata economica (e magari si tratta di cose molto più piccole delle nostre) ma salvaguardate da una politica seria. |
|
Post n°406 pubblicato il 15 Maggio 2018 da paoloalbert
Vedendo la mia centrifughina autocostruita mi è venuta nostalgia di quei bei problemi di fisica che si facevano una volta.
Fare l'attrezzo in teoria è semplice, ma è pacifico che occorre, oltre alla opportuna manualità, anche una officinetta attrezzata con gli strumenti che servono; per me nulla è più impagabile (ed usato) di quel laboratorietto meccanico che sta in quella piccola costruzione incoronata da quella superba rosa rampicante come s'è visto qualche anno fa (link) e che anche adesso è fiorita così. |
|
Post n°405 pubblicato il 02 Maggio 2018 da paoloalbert
Finalmente la lunga lezione in cinque puntate del Prof. Catullo è finita e possiamo tornare a noi.
Per separare il ferro dal rame ho parzialmente evaporato (non arrivando a secco) per eliminare la maggior parte degli acidi residui, poi diluito opportunamente e ripreso alla fine con un eccesso di ammoniaca.
Ho pertanto messo in azione la mia centrifugaccia autocostruita dividendo la sospensione in più porzioni fino a separare perfettamente l'idrossido dal liquido ammoniacale limpido. Eccolo, ed è apparso anche il colore azzurro del complesso.
Ho già parlato di questo bellissimo saggio per il rame (link) ed l'ho voluto usare sia per la sua sensibilità sia perchè mi è particolarmente simpatico. Le quattro provette seguenti contengono da sinistra rispettivamente due soluzioni con qualche goccia di soluzione da esaminare, la soluzione di etilxantato di potassio (CH3-CH2-CS-SK) e la soluzione con quel poco di CuCl2 derivante dal minerale.
|
|
Post n°404 pubblicato il 25 Aprile 2018 da paoloalbert
Capitolo di metallurgia, tratto da un manoscritto sulle miniere della Provincia Bellunese… (Parte quinta e ultima– Ved. Post precedente)
Par. VI – Terza fondita I kretz staccati dalla manica, dopo compita la seconda fusione, vengono uniti agli stoni rifusi calcinati, e dalla fondita di tali sostanze si conseguisce lo ston sottile, o metallina. Il prodotto che fornisce questa operazione è di tinta grigia, offre il brillante del piombo, ma più appannato, e presenta una frattura composta di piccoli cannelini, dentro i quali si vedono i fili di rame metallico. I pezzi sono assai fragili, ed hanno due linee circa di grossezza.
Par. VII – 4° Torrefazione La metallina non si abbrustolisce che una sola volta; e a fronte del poco tempo che rimane esposta al fuoco delle roste, si formano nulla meno sopra di essa la malachite ed il rame ossidulato, la cui tinta risalta molto più di vaghezza che l’altra, che distingue le due specie illustrate nel quinto paragrafo, e si mantiene per un tempo assai più lungo. Da questa operazione si ottengono dei pezzi che hanno la forma di grosse concrezioni tubercolose, le quali conservano tutta l’apparenza del rame metallico, sebbene alquanto sudicio.
Par. VIII – Quarta fondita Con la metallina calcinata, si fondono le deposizioni raccolte nel bagno acqueo, dove s’immerge il rame rosetta per raffreddarlo; lo spolvero (rame sublimato in globetti) del camino annesso al forno di raffinazione, ed i kretz della fondita antecedente. Il prodotto che si ritrae da questa operazione, è una massa compatta del colore del tartaro che si cava dalle botti, e porta il nome di rame nero. Talvolta si ottiene il rame nero dalla fondita degli stoni rifusi calcinati; ma in questo caso conviene passarlo alla rosta, prima di assoggettarlo all’ultima fusione.
Par. IX – Ultima torrefazione Il rame nero si estrae dal bacino sotto forma di dischi del diametro di due piedi, e della grossezza di quattro o cinque linee; e dopo di averlo raffreddato nel bagno, lo si adagia sul terreno, e si ricopre di legna e di carbone polverizzato. Appiccatovi il fuoco, si cerca di regolare l’operazione in modo che il metallo non abbia a soffrire alcun principio di fusione; poi si levano i dischi metallici, e con mazze di ferro si percuote la loro superficie, onde separarne le scaglie ferruginose, che sopra vi aderiscono.
Par. X – Ultima fondita Detersa che sia la superficie dei dischi dalle scaglie ferruginose, si traporta il metallo nel forno di raffinazione, e lo si fonde, affine di ossidare o scorificare il resto del ferro che lo rende impuro. Il prodotto che ci somministra quest’ultima fusione presenta tutti i caratteri del rame metallico puro. Tali sono le operazioni che si eseguiscono in Agordo sopra la pirite cuprea, onde ottenere il rame nello stato di purità.
…°°°OOO°°°…
Qui termina il capitolo del manoscritto di Tomaso Antonio Catullo sulla miniera Agordina, dal quale voglio trarre solo un paio di conclusioni sostanziali: - quanto fossero lunghissime, laboriose e dispendiose le operazioni per estrarre il metallo dal minerale;
- quanto il buon esito di tutto il lavoro fosse soggetto alla capacità personale dei mastri minerari e metallurgisti. Essi dovevano decidere quasi tutto in base alla loro esperienza, dalla quale in definitiva dipendeva il rendimento economico della miniera. Senza contare il dispendio energetico umano, allora di poco conto (c’erano anche tanti teneri e vispi fanciulli che collaboravano!, oltre al durissimo lavoro del minatore), il dispendio energetico in termini di combustibile (legna e carbone) era evidentemente enorme, ed a farne le spese erano, nel caso in oggetto, le foreste bellunesi, apparentemente inesauribile fonte vegetale sia per gli interminabili fuochi necessari per l’estrazione mineraria del Doge sia per il legno delle sue navi. Dal punto di vista puramente tecnico ricordo un particolare fondamentale del testo del Prof. Catullo ma che può sfuggire ad una lettura affrettata: il medesimo sottolinea l’importanza (ved. parte terza) dell’aggiunta dello schisto argilloso durante il processo di fusione, auspicandone anzi l’integrazione con minerale quarzoso, al fine di separare il più possibile il ferro dal rame sotto forma di scoria. Tale processo è infatti fondamentale nel caso di minerali ferro-cupriferi, secondo la reazione che semplificando al massimo può essere riassunta: FeO + SiO2 = FeO.SiO2 silicato ferroso che combina selettivamente il ferro (ossidato nei processi di torrefazione) a formare un silicato facilmente fusibile e separabile; il rame, più pesante, si concentra sul fondo del forno ed il silicato, portandosi via il ferro, galleggia come scoria e viene separato. I campioncini di Marco di cui parlavo all’inizio dovrebbero essere proprio di questa natura; vedremo in seguito se un po’ di rame ne sarà rimasto inglobato.
|
|
Post n°403 pubblicato il 19 Aprile 2018 da paoloalbert
Capitolo di metallurgia, tratto da un manoscritto sulle miniere della Provincia Bellunese… (Parte quarta/5 – Ved. Post precedente)
Par. V – Torrefazione
Gli stoni rifusi si recano nei luoghi destinati per le arrostiture, dove si collocano di bel nuovo sopra i carboni per torrefarli. Tale operazione viene replicata cinque o sei volte di seguito, prima di sottomettere gli stoni ad una nuova fondita; e con queste ripetute arrostiture si separano le ultime porzioni dello zolfo, e si facilita sempre più la concentrazione del rame. Durante questo processo si possono vedere sulla superficie dei pezzi che si abbrustoliscono, i più bei saggi di rame ossidulato rosso, e di rame carbonato verde, ambedue sotto forma di concrezioni fungiformi, leggierissime, e facilmente polverizzabili. L’azione del fuoco ha dunque potuto operare la conversione dei fili di rame, in rame ossidulato, il cui aspetto è poco o nulla dissimile da quello che distingue il rame rosso di Cornovaglia analizzato dal Chevenix; e l’azione combinata del fuoco, del carbonio, e dell’aria ha dato origine alla malachite. Per avere una conoscenza esatta della natura di quest’ultima specie, non mi sono accontentato dell’effervescenza che vi suscitò l’acido nitrico versato a gocce sulla medesima, ma vi volli far passare nell’acqua di calce il gas acido che da essa si dipartiva, per osservarne gli effetti. L’intorbidamento dell’acqua mi raffermò nell’opinione che io aveva intorno all’indole del minerale. Questo interessante fenomeno avvalora l’idea concepita dal Breislak sull’origine della calcaria primitiva; il Sig. Breislak difende la fluidità ignea della terra, e crede, che allorquando la materia andavasi raffreddando, l’ossigeno si sia unito al carbonio, ed abbia generato l’acido carbonico, il quale, combinandosi con la calce elementare, diede formazione ai monti calcarei primitivi. Anzi se vogliamo ben esaminare le circostanze che concorrono alla genesi del carbonato di Agordo, si troverà che l’opinione di questo celebre geologo viene appoggiata direttamente dalla mia osservazione, che dalle esperienze dell’Hall, e dal Bucholz, sopra cui egli fonda la sua ipotesi. Il Sig. Hall, mediante la compressione ed il calore, convertì le polveri della calcaria in una pietra effervescente negli acidi, dura, e di una grana analoga a quella dei marmi salini: ed il Bucholz, spingendo ad un fuoco violento la creta polverizzata, ottenne, senza la compressione, una massa dura, solida, semifusa, e d’un bianco giallastro, che inclinava alcun poco al rossastro. Si vede che i due chimici hanno sperimentato sopra la calce unita all’acido carbonico, mentre negli stoni di Agordo, questo acido non preesisteva alla formazione della malachite, ma si è invece generato nel progresso della combustione; come appunto il Breislak immaginò essere accaduto, nell’epoca in cui si sono formate le gran masse di calcaria primitiva. Non mi venne mai di adocchiare, fra le specie minerali generate dal fuoco, nella terza arrostitura, il rame bleu, sebbene, sulle cognizioni che abbiamo sulla di lui natura, non mancassero i materiali necessarj alla produzione di questo sale. Sono entrato perciò nel sospetto, che la varietà del colore dei due sali di rame, non provenga dallo stato nel quale si trovano le loro basi, e conseguentemente non si abbia ancora potuto assegnare la vera cagione della differenza che passa tra un carbonato e l’altro. Pelletier si studiò d’indagare la causa che produceva questa diversità di colore nelle specie in discorso, e credè di trovarla nella minore o maggiore quantità di ossigeno di cui erano provvedute le basi metalliche.. Quindi la tinta verde della malachite fu dal Pelletier attribuita al perossido di rame, perché tale era lo stato del metallo in questa specie, laddove il rame bleu conteneva in assai minor dose l’ossigeno. Ma in questo mezzo comparve l’analisi del Klaproth, che mostrò tutto il contrario; per lo chè hanno dovuto i mineralogisti modificare le loro idee sulla costituzione chimica delle due specie. Noi potremmo tuttavia muover dubbio sulla legittimità delle conseguenze che si vollero dedurre dalle analisi, imperocchè, se la differenza di colore nei due minerali derivasse dalle varie dosi d’ossigeno contenute nelle loro basi, si avrebbe dovuto trovare, fra gli stoni di Agordo, il rame bleu, giacchè i due ossidi di questo metallo si possono ravvisare tanto sulle maggiori superficie dei pezzi arrostiti, che sulle cellule di cui è sparsa la loro frattura. L’osservazione mi ha fatto conoscere che il rame verde si forma costantemente sulla parte esteriore degli stoni, ch’è la più ossidata, come lo indica la sua tinta bruno carica; mentre nei vani della spezzatura, vi ho sempre incontrato l’ossido minore di rame, o rame rosso, di cui si è fatto parola più sopra. L’acido carbonico, col quale si trovano sempre al contatto i due ossidi, diede origine alla malachite; ed avrebbe potuto generare anco il rame bleu, se la mancanza di un qualche mezzo, che noi ignoriamo, non avesse arrestata la sua formazione. Sembra dunque che il processo seguito dalla natura, nell’imprimere nei due sali un colore diverso, sia più recondito di quello che si è finora immaginato (Klaproth ha ricavato meno ossigeno dal rame contenuto nella malachite che dall’altro separato dal rame bleu). Fine quarta parte
|
|
Post n°402 pubblicato il 14 Aprile 2018 da paoloalbert
Capitolo di metallurgia, tratto da un manoscritto sulle miniere della Provincia Bellunese… (Parte terza/5 – Ved. Post precedente)
Abbiamo veduto più sopra, che lo schisto è il fondente impiegato in questa operazione; e qui aggiungeremo essere due le varietà di tal pietra, che si antepongono alle altre; lo schisto steatitico cioè, e lo schisto nero, rocce che formano quasi la totalità delle montagne poste a nord della miniera. Sulla pietra arrostita come fondente, parmi possa aver luogo una discussione metallurgica, imperciocchè, se con unanime accordo i metallurgisti hanno surrogato a molti altri fondenti terrosi la calce, a che perseverare nell’antica costumanza di usare lo schisto? Al bravo e zelante Sig. Zanchi Direttore dei lavori, non deve essere ignota l’efficacia con la quale opera la calce sulle miniere d’indole piritacea (la calce non agisce solamente come flusso, ma serve a neutralizzare tutto l’acido che si forma durante la liquefazione della miniera); e perciò io credo ch’egli preferisca a questa lo schisto, onde ottenere gli stoni meno carichi di ferro, ed evitare ad un’ora alcuni altri inconvenienti, che sogliono accompagnare la fondita. Per avere una precisa notizia sulle varietà di schisto dell’Agordino, ho cercato di segregare con l’analisi le terre che entrano nella loro composizione, e trovai che la varietà nera contiene 54 parti di silice, 20 di allumina, 9 di calce, 5 di magnesia, 4 di ferro, e 8 di perdita: e che lo schisto steatitico somministra 47 di silice, 20 di magnesia, 18 di allumina, 6 di calce, 1 di ferro e 7 di perdita. Da ciò chiaramente apparisce, che codesti schisti non s’impiegano per ottenere gli effetti che suol produrre la calce; né tampoco per trarre profitto dall’allumina, e dalla magnesia; imperciocchè, la prima di queste terre, vi esiste in dose assai modica per riescire vantaggiosa; e le altre due si considerano poco utili al buon esito dell’operazione. A tal fine si recò egli alle miniere di rame piritoso poste a S.Bell; e dopo aver istituite sul luogo molte esperienze sintetiche, e fatta l’analisi di tutti i prodotti che si ottengono da ciscuna operazione, ebbe a concludere, che il ferro della pirite, appena trasmutato in ossido, si combina alla silice, e forma con essa un vetro assai fusibile; mentre il rame si concentra nella metallina (ston sottile), dalla quale, col mezzo di ulteriori torrefazioni, si elimina il resto dello zolfo; e l’ossido di ferro, che ancora contiene la medesima, si separa mediante il ministero della silice, che vi si unisce di nuovo, prima di sottoporla ad una novella fondita. Ora, ritornando alla preminenza che si dà allo schisto, in causa della silice che contiene, io trovo che questa terra, essendo combinata chimicamente all’allumina, alla magnesia, e ad altre sostanze straniere alla sua natura, non può contribuire alla separazione del ferro con tutta quella efficacia che si desidera; e perciò io insinuo di sperimentare il quarzo polverizzato in luogo dello schisto, e di mescolare ad esso un terzo di carbone calcario, o meglio ancora, di calce viva, escludendo la pirite, che si adopera per salificare gli ossidi di ferro, a spese dell’acido che somministra. Credo di aver addotto bastanti ragioni onde provare l’utilità che trarre si potrebbe dalla silice e dalla calce, qualora di volesse surrogarle allo schisto e alla pirite; tanto più che l’aggiunta di quest’ultima non è generalmente adottata; imperciocchè, se dall’un canto favorisce la fondita, dall’altro rende più complicate le operazioni, o almeno più lunghe dell’ordinario; e ciò principalmente in causa d’una maggiore quantità di ferro, di cui si caricano gli stoni.
Non è di necessità in questa operazione di coprire il minerale con la solita terra ocracea, essendo bastanti le muraglie per impedire all’aria di insinuarsi con forza attraverso i lati della rosta, e sturbarne quindi la combustione. Dopo alcuni giorni di fuoco, si estraggono gli stoni arrostiti, e si trasportano al forno per assoggettarli ad una seconda fondita. Terminata l’arrostitura, si osserva, che gli stoni hanno assunto caratteri diversi da quelli che manifestavano prima di essere calcinati. I pezzi si convertono in una massa concrezionata, di color bruno lucente, nei cui vani si scorgono di sovente alcune laminette di rame metallico.
Par. IV - Seconda fondita Agli stoni calcinati si uniscono le grassure (fu imposto il nome di grassure all’ossido di rame conseguito dalla scomposizione del solfato di questo metallo, col mezzo della ghisa, o ferro impuro di ossigeno), i kretz della fondita precedente, e quelli cavati dal bacino del forno di raffinazione, onde sottoporre il tutto alla fusione. A questi prodotti si sogliono aggiungere anche quei frammenti che si staccano dal rame nero mentre resta nel bagno acqueo per raffreddarsi; i quali si raccolgono sul fondo della fossa dopo avervi estratto il metallo. Nel corso di questa operazione nulla v’ha di osservabile, o di nuovo, perché viene eseguita con le medesime regole della prima, e in un forno analogo a quello in cui si sono ottenuti gli stoni crudi. Il materiale che si ricava da questa fondita dicesi ston rifuso, e corrisponde a ciò che i tedeschi chiamano spurstein. E’ desso di color grigio all’esterno, ma rubiginoso nella frattura; e qualche volta di una lucentezza che molto assomiglia a quella dell’argento rosso dei mineralogisti. Il suo interno è inegualmente seminato di piccole cellule dentro alle quali si vede il rame metallico, disposto in finissime e corte spille riunite in fascetti, e aggomitolate fra loro. Molti di questi saggi sono stati spacciati dai mercanti diminerali per rame nativo. Fine terza parte
|
|
Post n°401 pubblicato il 09 Aprile 2018 da paoloalbert
Capitolo di metallurgia, tratto da un manoscritto sulle miniere della Provincia Bellunese… (Parte seconda/5 - Ved. post precedente)
Torna qui in acconcio entrare in qualche disquisizione sopra un fenomeno, che offrono i pezzi dopo l’arrostitura, i quali anziché contenere il rame equabilmente sparso in tutta la loro massa, come allora che dalla miniera vengono estratti, lo contengono in assai maggior dose nel nucleo; e la crosta rimane impoverita, come il Brocchi ha voluto assicurarsene coll’analisi. Questo fenomeno fu allegato dal Breislak, onde vi è meglio appoggiare la di lui teoria sull’origine delle miniere; pensando egli, che i depositi metalliferi, allorchè le montagne erano ancora in uno stato fluido, o pastoso, si sieno formati in virtù dell’affinità, che gli elementi omogenei esercitano tra di loro; e per conseguenza, le molecole integranti del minerale, abbiano potuto attrarsi, e segregarsi dalle altre, che vi erano frapposte. Tutto che l’ipotesi del nostro cel. Breislak sia la più ragionevole, e la meno intralciata di quante sieno state proposte finora per ispiegare l’origine dei filoni; pure col sussidio di essa non si possono assegnare le cagioni che hanno obbligato il materiale metallico a rimanere sparpagliato nella roccia, senza obbedire agli impulsi delle reciproche attrazioni. L’osservazione ci istruisce, che molti minerali metallici trovansi disposti in piccoli grani sparsi nella massa pietrosa delle montagne; e molti formano parte integrante delle rocce omogenee. Questo fatto è così comune nella natura, che non si potrebbe, se non a torto, attribuirlo a cause accidentali, occorse soltanto in alcuni terreni; ne tampoco ripeterlo dall’indebolimento delle forze attrattive; imperocchè codesti grani si trovano spesso nicchiati dentro a rocce antichissime, formate cioè in un tempo, in cui le affinità chimiche dovevano agire con la massima energia. Del resto, gli esempi d’una manifesta attrazione, che tra loro esercitano le molecole del rame, sebbene frammiste a quelle dello zolfo e del ferro, non si adocchiano solamente nei cumuli di torrefazione, ma sono inoltre frequenti in tutti i prodotti delle molteplici operazioni cui si assoggetta il tazzone, per ricavarne il rame rosetta. Il metallurgista che giunge alla miniera di Agordo, vede a primo colpo d’occhio, che il processo di riduzione colà introdotto, altro non è che una successiva e graduata separazione delle molecole raminose, le quali, abbandonando la superficie, si vanno a radunare nella parte centrale dei pezzi che si cimentano. In conformazione di ciò basta osservare la spezzatura dello ston, ch'è il prodotto della fondita del tazzone, e si scorgerà nel centro di esso dei piccoli fili ed alcune laminette di rame metallico; le quali cose si possono anche vedere nell’interno dei pezzi che si sottopongono ad ulteriori torrefazioni, non nel tazzone, come è stato annunziato da altri. Prima di compiere questo paragrafo, è giusto dar merito a quelli che hanno ideata la maniera di torrefare la pirite nel modo che abbiamo indicato, poiché le fatte modificazioni hanno così mirabilmente tolti di mezzo gli inconvenienti che derivano dall’antico metodo, che sarebbe impresa di non facile esecuzione, e forse inutile, voler adesso introdurre dei nuovi cambiamenti, onde il processo avesse a tornare più proficuo all’amministrazione. S’è poi vero, che settant’anni addietro, il processo d’arrostitura fosse portato al grado di perfezione che si osserva oggigiorno, come sono inclinati a credere coloro che lavorano intorno ai cumuli, di maggior laude sarebbero condegni gli innovatori, imperciocchè apprendiamo dai metallurgisti tedeschi, come in quell’epoca fosse appo loro imperfettissimo il metodo di torrefare la pirite di rame. Henkel, parlando delle operazioni metallurgiche ch’erano in vigore a suo tempo nelle miniere di Rammelsberg, si spiega, riguardo la torrefazione, nel modo seguente. -Ridotta la pirite in piccoli pezzi, si formano con essa dei mucchi di tre piedi di altezza, e venti piedi circa di lunghezza e larghezza. Tutta la parte superiore si copre di legna ben secche e stivate, finchè il mucchio arriva all’altezza di sei piedi. Sopra questa legna si colloca dell’altro minerale, e quando il mucchio arriva all’altezza di nove piedi si ricoprono i suoi lati con i frammenti più minuti della miniera. Nel mezzo del mucchio vi sono delle altre legna, che dal fondo emergono fino alla cima; e sopra di queste si getta una quantità di scorie roventi per accenderle- Ai molti inconvenienti che fluire dovevano dall’esposto processo, si aggiunge lo svantaggio che recava alla miniera l’inutile consumo del combustibile. °°°°°
Par. II – Prima fondita Il tazzone non è il solo materiale che si destina per la prima fondita, ma a questo si uniscono i prodotti di molte altre operazioni. Tali sono i brunini (un ossido di rame impuro di ossido di ferro, che si consegue lavando le grassure ottenute nel processo di cementazione), i frammenti di stop calcinato, che si rinvengono sul fondo del terreno dopo compiute le arrostiture, i krets (quell’incrostazione che si forma sulle pareti interne nella manica del forno) ottenuti tanto per via secca che per via umida; le loppe grasse, che si ritraggono dalle varie fondite, alle quali si associano per ultimo la pirite cruda e lo schisto argilloso. E’ chiaro, che le ultime due sostanze si aggiungono alla mistura per determinare più sollecitamente la liquefazione delle parti metalliche, e per facilitare la separazione del rame, a cui si crede comparta energia l’addizione della pirite. Per ispiegare gli effetti che derivano dall’unione della pirite cruda durante la fusione, io suppongo che una gran parte del ferro, di cui è ricco il tazzone, venga salificata dall’acido dello zolfo contenuto nella pirite; e ridotta che sia in una specie di colcotar, si gonfi, si vetrifichi, e si trasformi in loppe; laddove le molecole del rame, che hanno potuto svincolarsi dalle altre sostanze eterogenee, si assemblano fra di loro; e divengono specificamente più gravi, si precipitano, unitamente al ferro degli stoni, nelle parti più basse del recipiente, o bacino scavato ai piedi del forno. L’acido dello zolfo non attacca solamente il ferro, ma entra in combinazione con tutte le terre salificabili, che conteneva la miniera, e con quelle ancora che si uniscono alla vena, onde favorirne la fusione. Codeste terre, allorchè si sono trasmutate in Sali, assumono un aspetto vetrino, si combinano al sale di ferro, e formano con esso quella massa porosa e leggiera, che soprannuota nel bacino, e che dicesi loppe. Caricato che sia il forno delle materie suaccennate, e del carbone, si procede alla fondita. Quello a cui spetta il regolamento di questa operazione, esamina attentamente tutte le parti esteriori del forno, onde assicurarsi della loro solidità; poi ordina ai Braschini di accendere il forno, e di regolare le cariche del combustibile a norma del bisogno. In capo a cinque o sei ore il minerale passa allo stato di compiuta fluidità; e si giudica che la fondita possa riescire bene, quando le parti metalliche, e le altre materie messe in fusione, escono pel foro uniformemente, e senza intermittenza. Succede spesse volte, che una gran porzione del minerale, forse per non essere ricoperta a dovere dal carbone, s’impadrnisce dell’ossigeno, si conglutina, e forma degli ammassi di mole così grandiosa, che la manica, non essendo più capace di contenerli, si spezza in vari luoghi, e mette fuori di stato gli operai di più oltre progredire nel lavoro. Questi ammassi altro non sono, che ferro mal fuso mescolato a poco rame; essi estraggonsi a stento dal forno, e ricevono da quelle genti il nome di ferro lovo, volendo alludere, con tale denominazione, ai guasti che producono nella manica simili ingorgamenti. I forni di Agordo sono muniti di un foro praticato verso il loro fondo, e di un bacino destinato a ricevere la massa fluida che sgorga dal foro, composta del materiale dello ston mescolato a quello delle scorie. Gli strati che galleggiano alla superficie del bacino, si raffreddano mediante l’influenza dell’aria esterna, e vengono levati di mano in mano che compariscono, finchè si arriva a trovare gli strati dello ston, che come più pesanti, sono sempre coperti da quelli che formano le scorie. Lo ston, che si raccoglie sul fondo del bacino, è alquanto fragile; di aspetto semivetroso, e di colore bruno cupo. Si ottiene in pezzi di forma circolare, grossi mezzo pollice, e anche più, nel cui interno si ravvisano dei fili di rame metallico. Da questa operazione si conseguiscono i prodotti qui sotto segnati. 1- Le loppe o scorie, la cui qualità serve d’indizio per argomentare se l’operazione succede a dovere. 2- Gli stoni crudi (Rohstein). 3- Le incrostazioni (Kretz) che si levano dalla manica interna del forno, dopo compiuta la fondita.
Fine seconda parte
|
|
Post n°400 pubblicato il 04 Aprile 2018 da paoloalbert
Capitolo di metallurgia, tratto da un manoscritto sulle miniere della Provincia Bellunese… Di Tommaso Antonio Catullo, Professore di Tecnologia e Storia Naturale nel Liceo di Verona (Parte prima/5 - Ved. post precedente)
Le varie operazioni metallurgiche, a cui si fa soggiacere una particolare varietà di rame piritoso, che da due secoli fu scoperta nelle montagne dell’Agordino, e che rese famosa la miniera donde si ritrae, meritavano, per mio avviso, di essere conosciute dai Professori di tecnologia, e da tutti quelli che si sono istruiti nell’arte di trattare in grande i metalli. I primi troveranno nella descrizione dei prodotti, e nel metodo che s’impiega per conseguirli, nuove cose da aggiungere alle loro lezioni; ed i secondi stupiranno che il minerale si assoggetti ad un così lungo giro di operazioni, prima di ottenere il rame nello stato di purità; mentre i processi che vengono altrove praticati, sono molto più semplici e meno dispendiosi. Ma l’indole della pirite di Agordo è tale, che cimentata in mille guise dal laborioso e zelante Sig. Zanchi, direttore dei lavori, fu trovato ch’essa rifugge da qualunque altro trattamento, e per conseguenza riuscirono finora frustranee le modificazioni indicate dai metallurgisti che visitarono la miniera, onde perfezionarne l’antico metodo. Niuno peraltro si è avvisato d’insinuare l’uso della silice, in sostituzione dello schisto, che ancora s’impiega nella riduzione della pirite; e perciò mi sono studiato, nel secondo paragrafo, di far conoscere i vantaggi che trarre si potrebbero da questa terra, appoggiando i miei ragionamenti su quanto è stato osservato da un celebre chimico della Francia. Io doveva far precedere a questi capitoli la descrizione della miniera, ed aggiungere un qualche cenno sulla costituzione geologica dell’Agordino; ma per non oltrepassare i limiti d’una memoria, mi sono riserbato di supplire a questa mancanza in altra occasione. Processo di riduzione, o trattamento a secco della pirite per ricavarne il rame rosetta Par. I – Prima torrefazione La pirite, tradotta che sia alla luce del giorno, è destinata per l’arrostitura, ma prima la si mette in più tenui volumi; e quest’ultimo lavoro viene eseguito da un numero più o meno grande di fanciulli, dai nove ai dodici anni di età. A tal fine, questi teneri e vispi operai, adoperano un piccolo martello, il cui manico, lungo due piedi, od in quel torno, dev’essere costruito d’un legno alquanto flessibile, all’oggetto di frangere più facilmente la pirite, e ridurla in pezzi, che d’ordinario non eccedono la gossezza d’un pugno. Preparata la vena per l’arrostitura, viene trasportata con carrette nei luoghi esclusivamente destinati a questa operazione; e là si formano con essa dei cumuli quadrati, assettando i pezzi in maniera, che non abbiano a rimanere dei vani, e possa lo zolfo bruciare uniformemente, e svilupparsi per gradi dal minerale. I cumuli arrivano all’altezza d’un uomo, ed hanno quindici o venti piedi di lunghezza, ed otto o dieci piedi di larghezza, talvolta più, se la superficie del luogo è ampia e piana; giacchè queste varie dimensioni dei cumuli, sono sempre proporzionate all’estensione del terreno sul quale vengono eretti. Onde evitare possibilmente la dispersione dello zolfo, e fare che il calore vieppiù si concentri, e più regolarmente agisca su tutta la massa, si copre il cumulo con terra inumidita, di colore epatico, abbondante in què siti, e con minuzzoli della vena medesima; indi si appicca il fuoco alle legna preventivamente adagiate dentro a quattro grandi aperture, che si vedono nel fondo degli angoli di ciaschedun cumulo. Nel breve giro di dieci ore tutte le legna si consumano, e la pirite continua ad ardere per quattro o cinque mesi. Quando la materia, di cui sono ricoperti i cumuli, comincia a indurire, si escavano nella parte superiore di essi delle piccole buche, o bacini, che poi vengono intonacati con terra rossa impastata con argilla comune, ed anche con una specie di grauwake caduta in disfacimento. Dentro a questi bacini vi cola porzione dello zolfo; mentre altra porzione si deposita sui lati, e sulla superficie stessa dei cumuli, dove si sono scavate le buche; e siccome per difendere l’apparato di torrefazione dalle piogge e dalle nevi, si accostuma coprirlo con una tettoia di legno, così un’altra parte dello zolfo si gazifica e si sublima sotto alle tettoie stesse, sgombrandosi di quelle sostanze straniere, di cui non ha potuto spogliarsi totalmente lo zolfo che si raccoglie nei bacini. Lo zolfo sublimato, o in fiori, si stacca mediante un rastiatoio dalle tavole, poiché è compiuta la torrefazione; e l’altro dei bacini si estrare a quando a quando con grandi cucchiai di ferro, e si getta in appositi stampi. Incombe agli operai, che presiedono al buon esito dell’arrostitura, di regolare il fuoco in maniera, che il calore debba essere lento e moderato, e lo zolfo possa eliminarsi dalla pirite, senza che questa abbia a soffrire un principio di vetrificazione. Ad onta però di tutte le precauzioni messe in pratica, onde impedire che la pirite di soverchio si abbrustolisca, occorre il più delle volte di trovare varj pezzi di vena semifusi, o vetrificati; i quali vengono separati con diligenza dagli altri, e si gettano via come inutili, e come nocevoli alla fonduta del tazzone (viene così chiamato il prodotto della prima torrefazione). Terminata la torrefazione si levano a mano a mano i pezzi, e si assembrano in tanti mucchi, per essere da un’altra compagnia di fanciulli trattati a norma delle istruzioni ricevute dai capi che dirigono i lavori. L’incombenza loro consiste nello scegliere la pirite meglio torrefatta, ed ispogliarla col martello da una crosta screpolata e porosa che investe il tazzone, e che si forma durante l’arrostitura. La crosta, separata che sia dal nucleo, si serba pel processo di cementazione; e la parte centrale si trasporta alle fucine per sottoporla alla prima fondita. L’involucro che ricopre il tazzone, è di color rosso avvinato; si lascia facilmente sgretolare dalle dita; esposto per alcun tempo all’aria ne attrae l’umidità, e manifesta un sapore vitriolico, più gagliardo di quello che appalesa alla lingua, allora che viene tratto dal cumulo. Il nucleo, ch’è tuttora piritoso, assume un colore azzurrognolo screziato, oppure conserva la tinta naturale della vena, sebbene vieppiù rinforzata dal calore della torrefazione. Fine prima parte
|
|
Post n°399 pubblicato il 25 Marzo 2018 da paoloalbert
L'amico Marco, sapendo che ho un debole per le vecchie miniere, mi ha mandato fra l'altro un piccolo campione di residui di fusione di quel minerale che si lavorava un tempo nel giacimento della Val Imperina (Agordo), luoghi a lui famigliari. |
|
Post n°398 pubblicato il 16 Marzo 2018 da paoloalbert
SCENA II - Al Caffè Pedrocchi di Padova
Il 15 luglio 1789 (il giorno dopo della presa della Bastiglia. A proposito, caro Lavoisier: dovresti cominciare a pensare più al tuo collo che alla chimica...) il Carburi e l'Abate Fortis si trovano al Caffè Pedrocchi di Padova in erudita conversazione e per farla breve cominciano a bisticciare; uno (il Fortis) continua a sostenere che a Molfetta lui ha trovato una vera e propria "miniera" di nitro, l'altro (il Carburi) ammette senz'altro che il nitro c'è ma che le miniere di nitro (KNO3, insisto) non esistono.
Scende e visita accuratamente le grotte Ferdinando e Carolina ed in sostanza ecco le sue parole:
Trova anche che il pozzo da quale si attingeva l'acqua per le operazioni di lisciviazione dimostra di fornire acqua ricca di "muriato di soda e di magnesia", quindi addirittura salmastra! |
|
Post n°397 pubblicato il 07 Marzo 2018 da paoloalbert
Ho seguito qualche tempo fa una piacevolissima conferenza storica avente per tema "Le nitriere artificiali secondo il Conte Gazzola".
ATTORI DELLA COMMEDIOLA DI OGGI:
SCENA I - ANTEFATTO NEL PULO DI MOLFETTA
|
|
Post n°396 pubblicato il 26 Febbraio 2018 da paoloalbert
L'ho trovato non ricordo dove nella Grande Palude, gettando l'amo per chissà cosa. - si sommino poi tutti i cubi fra di loro ottenendo un altro numero; - anche di questo si faccia il cubo di ogni cifra e poi si sommino; - si continui in questo modo finchè dopo poco tutto termina... - con uno di questi numeri: - oppure con una di queste sequenze: |
|
Post n°395 pubblicato il 17 Febbraio 2018 da paoloalbert
Lasciamo che Biringuccio dalla Repubblica di Siena (1540) continui con il suo discorso sullo STAGNO:
...LA MINIERA sua anchor ehlo non la vedesse mai, perchè in pochi luochi pare che se ne generi. |
|
Post n°394 pubblicato il 11 Febbraio 2018 da paoloalbert
Ho già avuto occasione di parlare in passato di Vannoccio Biringuccio e del suo celebre libro "De la pirotechnia" (link) Beh, non è poi tanto difficile, vero? Il senso generale si capisce benissimo. Riassumendo: |






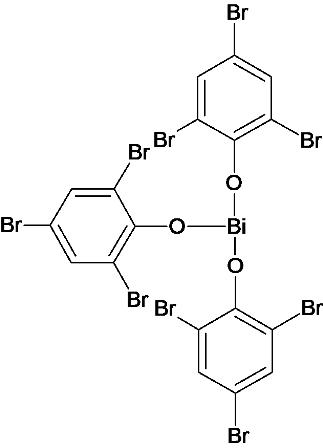 La formula sopra riportata è come la dice il Merk Index, tuttavia altre fonti occupano una valenza del bismuto con un ossidrile, e lo chiamerei in tal caso tribromofenato basico,
La formula sopra riportata è come la dice il Merk Index, tuttavia altre fonti occupano una valenza del bismuto con un ossidrile, e lo chiamerei in tal caso tribromofenato basico, 

















Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58