CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
|
Post n°173 pubblicato il 18 Aprile 2012 da paoloalbert
Se all'esame ti chiedessero: -"parlami della chimica del carbonio..." sicuramente non sapresti dove iniziare, perchè nella risposta ci sta tutto, e ancora di più. Preparazione dell' E questo è il cartellone dello spettacolo:
|
|
Post n°172 pubblicato il 13 Aprile 2012 da paoloalbert
Arrivare a due passi da una miniera senza vedere almeno un minerale utile di scavo è decisamente frustrante. |
|
Post n°171 pubblicato il 08 Aprile 2012 da paoloalbert
Dicevo l'altra volta che nel mio breve tour della Sardegna non avrei avuto quella mezza giornata a disposizione per cercare nella profumata macchia sarda la miniera di Zurufusu: infatti così è stato.
Ingurtosu, oggi
Resti di impianti e mineralizzazioni a blenda
Ruderi e discariche non mineralizzate
Ossidi di ferro nel Rio di Montevecchio
Fantasmi industriali lungo la strada Montevecchio-Ingurtosu
Alle dune di Piscinas: qui si imbarcava il minerale di piombo e zinco
|
|
Post n°170 pubblicato il 30 Marzo 2012 da paoloalbert
Mi tocca rinunciare! |
|
Post n°169 pubblicato il 19 Marzo 2012 da paoloalbert
La lettura casuale di un articolo del Journal of the Royal Society of Medecine ed il ritrovamento di un vecchissimo tubetto di un medicinale degli anni '50 (del quale riporto la foto) mi offrono l'occasione per qualche libera divagazione chimico-storica.
Come spessissimo accade quando si parla di chimica classica, la storia si svolge nella patria indiscussa di questa scienza, la Germania.
L'era dei barbiturici era cominciata, e sarebbe proseguita con successo per circa mezzo secolo, fino alla loro sostituzione con le benzodiazepine e prodotti meno pericolosi.
I barbiturici sono farmaci che agiscono come sedativi del sistema nervoso, con effetti che vanno da una lieve sedazione all'anestesia generale.
|
|
Post n°168 pubblicato il 11 Marzo 2012 da paoloalbert
|
|
Post n°167 pubblicato il 05 Marzo 2012 da paoloalbert
Ogni tanto ci scappa una digressione dalla chimica, in genere verso l'elettronica, un altro dei miei passatempi.
Questo apparecchietto è un'interfaccia tra il pannello solare, la batteria in tampone ed il carico utilizzatore e serve ad evitare le eccessive carica o scarica della batteria.
Il mio pannellino è solo un terzo di metro quadrato e fa un bel lavoro: pensiamo alle infinite aree su cui il sole splende in eterno ad 1 KW per metro quadro! senza servire nemmeno a far crescere l'erba... |
|
Post n°166 pubblicato il 29 Febbraio 2012 da paoloalbert
Guardate cosa m'ha regalato la gentile signorina Flavia per il mio compleanno: un bel filetto di platino nuovo!
Il filo nel suo "fodero" - Il filo pulito nella fiamma: nessuna colorazione
Il filo con una traccia di SrBr2: l'inconfondibile rosso dello stronzio |
|
Post n°165 pubblicato il 21 Febbraio 2012 da paoloalbert
Sul sito di Rosalba (Crescere Creativamente) è ospitato il quattordicesimo Carnevale della Chimica, che ha come tema "La chimica delle nascite", da interpretarsi naturalmente in senso libero. Dopo un po' nel bicchiere nuoterà una sgradevole torbidità marrone, che, agli occhi... degli allocchi sarà la prova inconfutabile che l'acqua, inizialmente bella, limpida e pulita, in realtà nascondeva chissà quali porcherie, abilmente tenute nascoste da quel cattivone del proprio Comune.
|
|
Post n°164 pubblicato il 20 Febbraio 2012 da paoloalbert
Ed eccoci a Pietrapertosa, sotto la neve, dall'unico posto in cui ho potuto fotografare un frammento di paese; impossibile fare quello che s'avea da fare in questa località (calpestare un po' di Dolomiti Lucane), ma visto il periodo basta essere riusciti ad arrivare... |
|
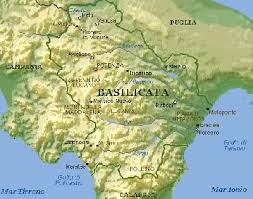
Post n°163 pubblicato il 15 Febbraio 2012 da paoloalbert
Visto il periodo favorevole (inverno...), il clima ideale (un freddo boia...), le precipitazioni scarse (mezza Italia sotto la neve...), le strade percorribili (con la motoslitta...), ce ne andiamo qualche giorno a fare i turisti in questa zona:
|
|
Post n°162 pubblicato il 08 Febbraio 2012 da paoloalbert
Oggi un grado sottozero nel mio lab, e un paio di notti fa meno quattordici fuori, là dove c'è il noce.
|
|
Post n°161 pubblicato il 03 Febbraio 2012 da paoloalbert
Visto il mio vecchio noce commentato in atmosfera invernale, l'amico Marco mi invita, credo scherzosamente, a meditare sull'estrazione dello juglone dai malli delle noci. Non è per niente una cattiva idea... ma ho già fatto questo lavoretto! L'ho fatto in maniera poco chimica in verità, tant'è che il recipiente ultimo di reazione non è un pallone o una beuta ma una affusolata bottiglietta dove il prodotto, o meglio quello che ne resta, si trova più a suo agio. Ecco qui sotto, fra i rami di un nocello giovane e ora spoglio che a suo tempo mi ha fornito i frutti, la sperimentale estrazione che ho fatto l'altr'anno.  Ne era venuto un nocino da fine del mondo, messo in cantiere come si deve proprio il giorno di San Giovanni, perchè non si dica poi che non si è fatto tutto in regola. Per un chimico le prove organolettiche sono ancor più di soddisfazione rispetto a un comune mortale; per esempio vengono assurdi pensieri come: -guarda che bel colore ambrato sempre più scuro che conferisce questo juglone (che è un naftochinone) al nocino che invecchia! -anche la catechina (un flavanolo) contribuisce all'aspetto, ma quanto? -che sia sovrastante il suo colore o il suo gusto astringente? -non par di sentire, all'assaggio attento, quella "legatura" tannica dell'acido gallico? -ma che gusto questa deliziosa mix di polifenoli! ... e così via ragionando... discorsi da fuori di testa dirà qualcuno al quale la chimica sta leggermente indigesta. Tornando in ambito chimico, ho visto girovagando in rete un bel lavoro sloveno proprio sull'estrazione dei polifenoli dallo Juglans regia, ovvero dal nostrano pregiato noce bianco. Il contenuto in juglone è abbastanza elevato (una quindicina di mg per grammo di noce verde), ma la separazione del medesimo da tutto l'estratto (il quale si può fare comodamente con i primi due alcoli), non è certo facilmente fattibile, o almeno non lo è con i miei mezzi. L'estratto di noce verde, che in definitiva non è altro che un "nocino" non zuccherato e non aromatizzato, contiene una bella serie di polifenoli (in genere sotto forma di glicosidi), tutte sostanze fortemente antiossidanti. Eccoli qui: 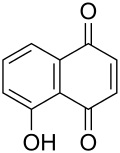 Juglone (relativamente tossico, 5-idrossinaftochinone 15 mg/g) 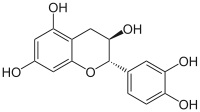 Catechina (colorante, astringente, 0,15 mg/g) 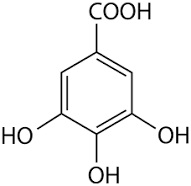 Acido gallico (3,4,5-triidrossibenzoico, astringente, 0,7 mg/g) 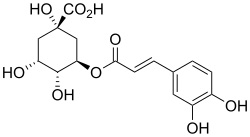 Acido clorogenico (un estere dell'acido 3,4-diidrossicinnamico, 0,05 mg/g) 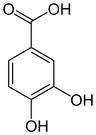 Acido protocatechico (3,4-diidrossibenzoico, 1 mg/g) Quando bevete un vero nocino modenese, siete avvertiti voi allergici alla chimica! |
|
Post n°160 pubblicato il 29 Gennaio 2012 da paoloalbert
L'inverno è invece la sua stagione: ecco come si pavoneggia, re nella natura dormiente. |
|
Post n°159 pubblicato il 21 Gennaio 2012 da paoloalbert
Sembra una di quelle frasi al limite del paradosso, come quando si dice per ridere: -sai la differenza tra...?
(Per ritornare poi a questa pagina cliccare sull'immagine o sul nome del blog, in alto) |
|
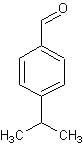
Post n°158 pubblicato il 16 Gennaio 2012 da paoloalbert
L'isopropilbenzaldeide, preparata, o meglio estratta, l'altra volta si presta perfettamente per un semplice e importante saggio della chimica organica analitica classica.
Ho eseguito la prova del saggio di Tollens sulla cuminaldeide usando un paio di ml di reattivo e una goccia di campione estratto.
Basta pochissima aldeide per far avvenire la reazione; ho provato con una frazione di goccia e la formazione dello specchio è ancora visibilissimo.
E' noto che il reattivo di Tollens va preparato al momento e non si può conservare perchè tende a formare, soprattutto in eccesso di ammoniaca e dopo reazioni intermedie, nitruro d'argento Ag3N. |
|
Post n°157 pubblicato il 10 Gennaio 2012 da paoloalbert
Qualcuno ha nell'orto il cumino? Il cumino è una pianticella erbacea di origine orientale della famiglia delle ombrellifere (come l'anice, il finocchio, il prezzemolo, ecc.) con dei piccoli semi oblunghi simili a quelli delle altre piante della famiglia. Solo due parole sull'uso di questa pianta: nella cucina indiana è uno degli ingredienti fondamentali del curry, mentre nella nostra gastronomia viene riservata perlopiù a preparazioni di "polveri" per insaporire le carni.
Ecco come ho proceduto per strappare a gran fatica quel poco di molecola odorosa che i piccoli semini cercavano di trattenersi con tutte le loro forze.
Nel nostro caso il vapore che si genera durante l'ebollizione è sufficiente a trascinare il prodotto in seno all'acqua che distilla (che infatti apparirà leggermente lattescente).
Il profumo non è proprio descrivibile, se non dire che è delicato ma molto speziato; insomma, sa proprio di... cumino!
Naturalmente il cumino contiene come al solito molte altre sostanze aromatiche oltre alla cuminaldeide, ma per la grande preponderanza che ha quest'ultima e per la procedura di estrazione, per i nostri scopi possiamo ritenere l'estratto come sufficientemente puro.
|
|
Post n°156 pubblicato il 02 Gennaio 2012 da paoloalbert
Anche questo è uno dei periodici intervallini, un po' diverso dal solito. Esisteva un tempo il Regno della STASI, una delle meno democratiche nazioni sulla faccia della Terra. Aveva (come il solito...) la parola "democratico" nel nome, e tanto basterebbe a renderla sospetta e sicuramente non confacente all'aggettivo. Ma aveva, quella Nazione, un inno nazionale meraviglioso, forse (per me) il più bello fra gli inni nazionali, capolavoro di Hanns Eisler; anche il testo (va ascoltato in tedesco!) è splendido. Ecco Auferstanden aus Ruinen:
|
|
Post n°155 pubblicato il 28 Dicembre 2011 da paoloalbert
Uno dei libri della mia piccola biblioteca ai quali sono più affezionato (sono affezionato a tanti, in realtà!) è questo che si vede qui sotto in fotografia:
Anch'esso ha contribuito a quell'imprinting che ha mi inoculato fin da giovane il virus chimico nel DNA. Lo sdoppiamento della personalità è descritta in modo magistrale da Stevenson, con tutti gli ingredienti per rendere il racconto estremamente avvincente, inserito profondamente all'interno di quella ben definita società vittoriana già di per sè avvincente, almeno per chi scrive, per la sua abissale differenza tra di essa e la nostra mediterranea imprevedibilità. -...a blood-red liquor, which was highly pungent to the sense of smell and seemed to me to contain phosphorus and some volatile ether...- -...the crushed phial in the hand and the strong smell of kernels that hung upon the air...- |
|
Post n°154 pubblicato il 25 Dicembre 2011 da paoloalbert
|
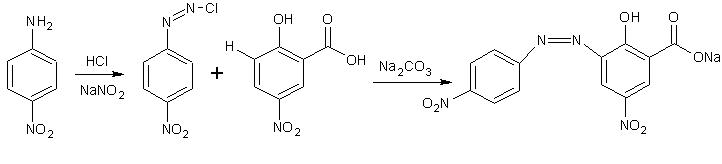
 Porre in una beuta da 100 ml 5 g di
Porre in una beuta da 100 ml 5 g di  Nel frattempo in un becker da 250 ml sciogliere 15 g di
Nel frattempo in un becker da 250 ml sciogliere 15 g di  Si forma prima un intorbidamento e poi un precipitato rosso scuro; lasciar riposare un paio di ore fino a reazione completa e poi portare a pH neutro con la giusta quantità di HCl.
Si forma prima un intorbidamento e poi un precipitato rosso scuro; lasciar riposare un paio di ore fino a reazione completa e poi portare a pH neutro con la giusta quantità di HCl.




























 - macinare i semi di cumino in un mortaio; sono resistenti, ma insistere quanto basta fino a renderli una farina discretamente sottile. Questa operazione permette anche di pregustare ampiamente il buon profumo della
- macinare i semi di cumino in un mortaio; sono resistenti, ma insistere quanto basta fino a renderli una farina discretamente sottile. Questa operazione permette anche di pregustare ampiamente il buon profumo della  - mettere i semi macinati assieme a 400 ml d'acqua in un pallone da 500 ml e predisporre per la distillazione con refrigerante Liebig e relativi accessori.
- mettere i semi macinati assieme a 400 ml d'acqua in un pallone da 500 ml e predisporre per la distillazione con refrigerante Liebig e relativi accessori.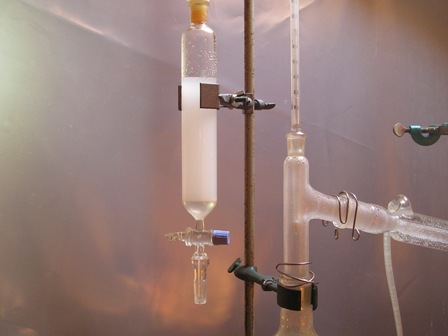 - porre il liquido distillato in un imbuto separatore ed estrarre con almeno 5/6 porzioni da 10 ml ciascuna di
- porre il liquido distillato in un imbuto separatore ed estrarre con almeno 5/6 porzioni da 10 ml ciascuna di 


Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58