CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Giugno 2012
|
Post n°186 pubblicato il 27 Giugno 2012 da paoloalbert
Questo dovrebbe essere l'ultimo lavoro riguardo la saga della silice blù, e l'inizio del periodo annuale di rarefazione dei post su questo blog. |
|
Post n°185 pubblicato il 21 Giugno 2012 da paoloalbert
Sono convinto che la realtà superi sempre la fantasia. |
|
Post n°184 pubblicato il 16 Giugno 2012 da paoloalbert
Il mistero del colorante blù del gel di silice continua... -"Come primaaa, più di primaaaa...", cantava una volta Tony Dallara!
Una volta arrivati a secco... ecco la prima sorpresa: un bel residuo inaspettato, color beige.
|
|
Post n°183 pubblicato il 13 Giugno 2012 da paoloalbert
Quando si ha a che fare con l'elettrochimica prima o poi non si scappa: si ha il problema del "vaso poroso"! E' un elemento indispensabile quando le soluzioni in gioco sono due (come spesso accade), le quali non devono mescolarsi ma deve essere consentito uno scambio ionico tra di esse. L'esempio classico sono le pile Daniell, Bunsen o Leclanchè, dove i due metalli sono nella rispettiva semicella separati appunto da un introvabile "vaso poroso". Anch'io non sapevo mai come risolvere questo problema... fino a ieri, quando sono riuscito inaspettatamente a farmi fare da un artigiano della ceramica il cilindretto che si vede in foto. Finalmente potrò tentare un esperimento di elettrochimica al quale pensavo da tempo e qualcos'altro che mi verrà in mente.
|
|
Post n°182 pubblicato il 08 Giugno 2012 da paoloalbert
I lettori più affezionati di questo blog ricorderanno che nei post dal 96 al 99 si parlò di un "C O L O R I M E T R O" che avevo costruito quasi per gioco, in una delle mie alternanze ricorrenti tra hobby chimico ed hobby elettronico.
Le due "protuberanze" in tubetto di rame che si vedono nell'immagine contengono rispettivamente un diodo LED di illuminazione (a destra) ed un fototransistor di lettura (a sinistra).
Naturalmente tutto questo è stato fatto per gioco (vogliamo essere più generosi? Diciamo allora per ricerca personale...) e non vi è nessuna velleità di misurazioni quantitative nè di impiego pratico di questo "colorimetro alla mia maniera". Ma rimane molto forte e impagabile, questa sì, la soddisfazione di aver fatto (e imparato!) qualcosa abbinando la teoria con la pratica, la chimica con l'elettronica... mixando semplicemente un paio di hobbies. Cosa si vuole di più? |
|
Post n°181 pubblicato il 03 Giugno 2012 da paoloalbert
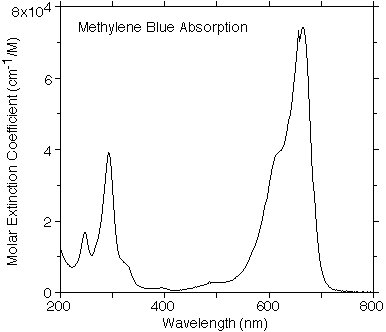
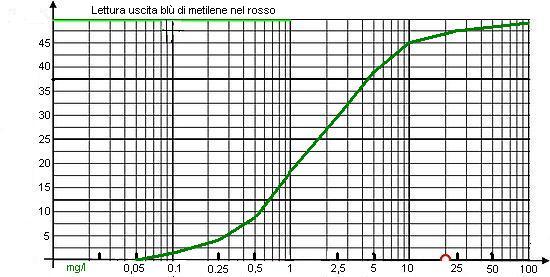
Una immagine vale come mille parole... si dice, ed è vero.
|






Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58