CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Agosto 2012
|
Post n°195 pubblicato il 28 Agosto 2012 da paoloalbert
Quest'estate ho fatto poca chimica sperimentale per colpa di qualcosa che sembrerà strano. |
|
Post n°194 pubblicato il 26 Agosto 2012 da paoloalbert
Chiamare "sintesi" questo esperimento è un po' pretenzioso: è talmente semplice che mi accontento del più modesto termine "preparazione".
Ecco finalmente 32 g di prodotto finito (circa 72% di resa), bello cristallino, inodoro e bianco come neve zuccherina, esattamente come... non ci si aspetta da una procedurra improvvisata e della quale si faceva in partenza poco conto. |
|
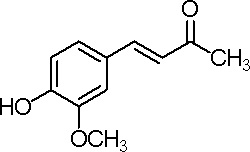
Post n°193 pubblicato il 18 Agosto 2012 da paoloalbert
Il nome altisonante di questa sintesi non rende giustizia alla sua discreta semplicità; è una sintesi carina e di soddisfazione nei risultati, anche se alla fine c'è "un'inezia" che personalmente avrei preferito non ci fosse: il doppio legame nella molecola!
Si tratta di una condensazione aldolica (ved. altrove), simile a quella presentata tempo addietro tra l'acetone e la benzaldeide per la sintesi del dibenzalacetone.
Dopo qualche minuto, se non si agita, si nota la formazione sul fondo di liquido rosso che si separa ma che si ridiscioglie semplicemente agitando.
Il solido filtrato si presenta microcristallino e di color verdino pallido.
Coprire il becher con vetrino d'orologio e lasciar raffreddare lentamente ed in riposo per qualche ora, fino a cristallizzazione completa.
|
|
Post n°192 pubblicato il 06 Agosto 2012 da paoloalbert
Mi piacciono le sostanze particolarmente "reattive": sono attrici dinamiche e vivaci, sulle quali si può contare quando c'è da imbastire una bella commediola che abbia come trama una sintesina di chimica organica.
Nel mio caso la "cappa" è costituita da una finestrella che si apre direttamente sul tetto dell'edificio dove ho il lab e che quasi sempre produce una utilissima corrente d'aria aspirante verso l'alto, come una perfetta cappa naturale.
Quando tutto l'acido è stato introdotto nel pallone, scaldare a riflusso per mezzo di un bagno d'acqua a 60-65° finchè non si ha più emissione di fumi bianchi (circa un'ora). Sostituire l'allhin con un condensatore Liebig e distillare raccogliendo fino a circa 65°
Il residuo, c
Questo cloruro acilico si presenta come un liquido incoloro mobilissimo fumante all'aria (si idrolizza istantaneamente ad acido acetico ed acido cloridrico), di odore estremamente acre ed irritante, corrosivo, da maneggiare con molta cautela ma utile in tante reazioni di acetilazione. |
|
Post n°191 pubblicato il 01 Agosto 2012 da paoloalbert
Gli alogenuri acilici sono reagenti fondamentali per la chimica organica per una nutrita serie di sostituzioni nucleofile, che avvengono ognuna nelle condizioni adatte. La prossima volta vedremo come. |
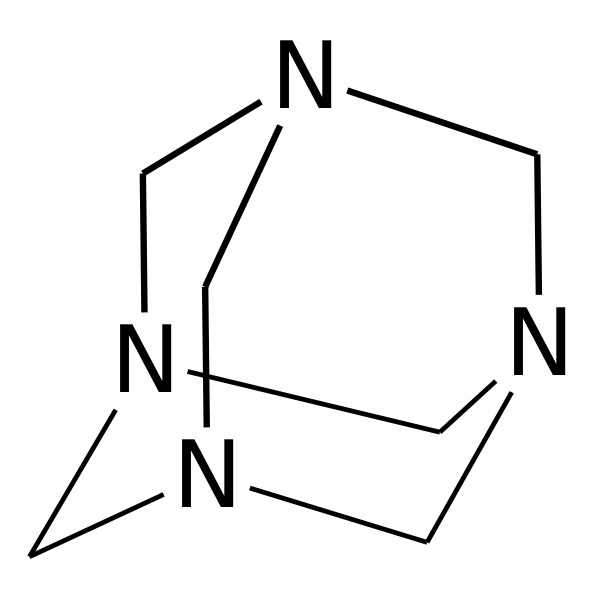







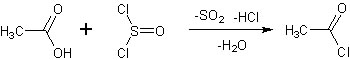
 In un pallone a due colli da 250 ml porre 80 ml di
In un pallone a due colli da 250 ml porre 80 ml di 

 ontenente chissà quali sottoprodotti clorurati, è estremamente irritante e lacrimogeno.
ontenente chissà quali sottoprodotti clorurati, è estremamente irritante e lacrimogeno. 
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58