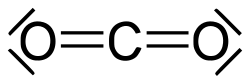LA SCIENZA PER TUTTI
Questo blog nasce dalla personale voglia di capire meglio l’universo che ci circonda e di trasmetterla alle altre persone attraverso quella che viene definita in modo generico la scienza. Il mio blog ha come obiettivo quello di diffondere la passione per le materie scientifiche e di far capire a tutti che se l’universo è di tutti anche la scienza è di tutti e per tutti!
| « IL SOGNO DI KEKULE’ | MOLECOLE UN PO’ …… ” PAR... » |
|
Proprio sessantacinque anni fa (23 marzo 1946) moriva a Berkeley uno dei chimici più famosi del secolo scorso: Gilbert Newton Lewis . Nato a Weymouth nel Massachusetts il 23 ottobre 1875, Lewis dedicò, dopo la laurea conseguita ad Harvard a 24 anni, tutta la sua vita alla ricerca in ambito chimico-fisico. Lavorò in Germania,nelle Filippine, per poi ritornare negli Stati Uniti presso il Massachusetts Institute of Technology e infine al Dipartimento di Chimica dell'Università della California nel 1912, posizione che mantenne per 34 anni, fino alla sua morte. Lewis è famoso, didatticamente parlando, per i suoi contributi alla definizione del legame chimico, ma come vedremo non solo…. Per farla breve, secondo Lewis le teorie del legame covalente legate alla molecola di idrogeno potevano essere valide e generalizzabili al resto delle molecole. Gli atomi con più elettroni possono condividere gli elettroni di valenza per formare legami covalenti completando il loro ottetto di elettroni. Il legame covalente può essere semplice se è condivisa solo una coppia di elettroni, doppio se sono condivise due coppie di elettroni, e triplo, se sono condivise tre coppie. Anche tra i diversi atomi si possono formare questi legami, pur nel rispetto della regola dell'ottetto. Ci sarebbero molte cose da spiegare riguardo al legame chimico e alla regola dell’ottetto secondo Lewis, ma per i più curiosi vi rimando a qualsiasi buon testo di chimica generale. Gilbert Lewis, con Merle Randall, pubblicò nel 1923 un famoso libro di termodinamica, in cui introdusse il termine fugacità per descrivere il comportamento di gas reali e la regola di Lewis e Randall viene utilizzata per descrivere il comportamento delle miscele ideali di aeriformi (gas) reali. Nello stesso anno elaborò la sua famosa teoria sugli acidi e le basi; un acido secondo Lewis è una specie in grado di acquistare una o più coppie di elettroni, viceversa una base di Lewis è una specie in grado di fornire una o più coppie di elettroni. Nel 1926 Lewis coniò il termine fotone per indicare il quanto di luce di Einstein. Nel 1933 sfruttò l'elettrolisi dell'acqua normale per produrre per la prima volta l'acqua pesante, che ha un ruolo importante nella tecnologia delle centrali nucleari a fissione. Lewis continuò le sue ricerche fino alla sua morte improvvisa per un attacco di cuore il 23 marzo 1946, nel suo laboratorio, circondato dai suoi Becher e provette. Qualsiasi libro di chimica generale presenta inoltre un capitolo dedicato alle strutture delle molecole secondo l’approccio di Lewis. La struttura di Lewis fu ideata e intitolata in suo onore. Essa si propone di rappresentare con un disegno bidimensionale la struttura di una molecola basandosi principalmente sulla regola dell'ottetto.
Questo approccio è notevolmente semplificato e non può essere applicato per tutte le molecole. Diciamo che è una buona base per ogni discussione successiva. Dopo queste informazioni vorrei ricordare che questo grande chimico statunitense non fu mai insignito del premio Nobel, ma per i suoi contributi soprattutto alla didattica è considerato tra i chimici più influenti del secolo scorso. Onore quindi a Gilbert Newton Lewis e un augurio a tutti i chimici o futuri chimici che possono dare un loro contributo, più o meno grande, a questa fantastica scienza sperimentale. Alla prossima puntata!
|
https://blog.libero.it/thomasthf/trackback.php?msg=10034221
I blog che hanno inviato un Trackback a questo messaggio:
|
 |
|
|
|
CONTATTA L'AUTORE DEL BLOG!
INDIRIZZO E-MAIL: thomasthf@libero.it
AREA PERSONALE
TAG
CHE ORE SONO?
MENU
CERCA IN QUESTO BLOG
I MIEI BLOG AMICI
ULTIMI COMMENTI
Inviato da: thomasthf
il 30/12/2013 alle 00:14
Inviato da: mmcapponi
il 29/12/2013 alle 19:03
Inviato da: thomasthf
il 02/06/2013 alle 18:01
Inviato da: professore.50
il 01/06/2013 alle 19:27
Inviato da: mmcapponi
il 25/12/2012 alle 14:39