L’intuizione del metodo di datazione del Carbonio 14 è dovuta a W. Libby che, per questa scoperta ricevette il premio Nobel nel 1960.
Il metodo, nella sua completezza, fu sviluppato nel corso degli anni seguenti grazie all’apporto di numerosi esperimenti.
Il carbonio è presente nell’atmosfera terrestre in composti (come CO, CO2, ecc); inoltre si trova nell’idrosfera attraverso la CO2 in soluzione e in ioni bicarbonico (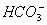 ) e carbonico (
) e carbonico (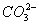 ).
).
Il carbonio è, infine, il costituente fondamentale di ogni sostanza organica e, quindi, di tutti gli organismi viventi.
Il carbonio, in natura, è presente in tre isotopi: 12C, 13C, 14C. Di questi, solo l’ultimo è radioattivo, mentre gli altri sono stabili.
Le loro percentuali di distribuzione in natura sono fortemente disomogenee:
12C 98,89%
13C 1,11%
14C 1,2 * 10-10%
Quest’ultimo si forma da un processo di reazione tra i neutroni termici, che sono i prodotti secondari dei raggi cosmici provenienti dall’ambiente extraterrestre e i nuclidi di 14N:
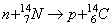
dove n indica i neutroni termici, 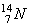 gli atomi di azoto, p i protoni.
gli atomi di azoto, p i protoni.
Il 14C così prodotto, reagisce con le molecole di ossigeno formando 14CO2 che si mescola con quella già presente in atmosfera e, diffondendo verso la bassa atmosfera, viene assorbita dalla biosfera e dall’idrosfera. Il processo di assimilazione è diretto per le piante, poiché avviene attraverso la fotosintesi clorofilliana, ed è indiretto per gli organismi che si nutrono di esse.
Inoltre la 14CO2 entra a far parte degli oceani come carbonato disciolto che viene utilizzato dagli esseri viventi nella formazione di conchiglie e nei depositi calcarei.
Essendo il 14C un isotopo instabile, decade secondo la reazione governata dalle interazioni deboli.
Ogni organismo, finché in vita, rimane in equilibrio con l’ambiente esterno scambiando 14C con il serbatoio cui appartiene. Dal momento della morte, cessano gli scambi col serbatoio e quindi viene meno l’assorbimento di 14C.
Perciò, la concentrazione di radiocarbonio nell’organismo, diminuirà secondo la legge di decadimento: 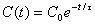 dove C0 è la concentrazione di 14C durante la vita e al momento della morte, t è il tempo trascorso dalla morte, C(t) la concentrazione di radiocarbonio all’istante t, t è la vita media della specie radioattiva che nel nostro caso vale t = 8267anni.
dove C0 è la concentrazione di 14C durante la vita e al momento della morte, t è il tempo trascorso dalla morte, C(t) la concentrazione di radiocarbonio all’istante t, t è la vita media della specie radioattiva che nel nostro caso vale t = 8267anni.
L’andamento è rappresentato in figura (il grafico mostra la curva tipica di un decadimento radioattivo).
 Dalla precedente relazione, assumendo che C0 e t siano noti e misurando C(t) si ricava
Dalla precedente relazione, assumendo che C0 e t siano noti e misurando C(t) si ricava 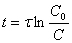 . Quest’ultima, deve essere corretta tenendo conto di alcuni fattori che contribuiscono alla variazione di C0 che sono:
. Quest’ultima, deve essere corretta tenendo conto di alcuni fattori che contribuiscono alla variazione di C0 che sono:
- frazionamento isotopico del carbonio;
- perturbazioni antropogeniche;
- fluttuazioni secolari del 14C nell’atmosfera.
Il frazionamento isotopico è dovuto a processi chimico fisici per i quali, nel passaggio da un composto all’altro, si verifica una partecipazione preferenziale per alcuni isotopi del medesimo elemento.
Anche il carbonio risente del frazionamento isotopico: infatti, nei processi di fotosintesi clorofilliana, viene preferibilmente scambiato l’isotopo più leggero, ovvero il 12C.
Ciò implica che, nelle piante, la quantità14C/ 12C è minore di quello presente in atmosfera.
Si dovrebbe, quindi, correggere questo effetto studiando tale rapporto.
Tuttavia questo non è facile da misurare in quanto esistono delle apparecchiature, chiamate spettrometri di massa, che non hanno una sensibilità sufficiente.
Nel 1954, Craig dimostrò che esiste una relazione tra questo rapporto e quello relativo alla concentrazione di 13C: 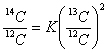 essendo K una costante di proporzionalità.
essendo K una costante di proporzionalità.
Le perturbazioni antropogeniche della concentrazione di 14C nell’atmosfera sono sostanzialmente dovuti a due effetti:
- effetto Suess
- effetto bomba atomica
Il primo effetto venne osservato da Suess nel 1955 misurando l’attività di radiocarbonio di alberi cresciuti nel 1950. Egli scoprì che la loro attività era minore di quella di alberi cresciuti nel XIX secolo.
Si ipotizzò che questa diminuzione di attività fosse dovuta alla rivoluzione industriale a partire dalla quale sono state immesse in atmosfera grosse quantità di CO2 provenienti dalla combustione del carbon fossile e del petrolio derivanti da sostanze organiche caratterizzate da un’età talmente elevata da non contenere più14C.
Il secondo effetto, invece, dovuto ai vari test atomici che nel corso degli anni ’50 venivano effettuati sulla superficie terrestre, contribuisce ad arricchire la percentuale di 14C in atmosfera. Infatti, queste esplosioni liberano una grande quantità di neutroni che, reagendo con 14N, danno luogo alla reazione di formazione del radiocarbonio.
Si è calcolato che l’entità dell’effetto Suess è pari circa al 2%; teoricamente questo effetto è presente anche oggi, ma, è molto minore dell’effetto bomba atomica.
Le fluttuazioni, o variazioni secolari, di 14C vennero evidenziate da De Vries. Egli, infatti, scoprì che la concentrazione di radiocarbonio nel 1700 e nel 1500 era stata del 2% più alta di quella del XIX secolo.
Studi successivi evidenziarono alcune possibili cause di questa variazione tra cui:
- variazione dell’intensità del campo magnetico
- modulazione del flusso dei raggi cosmici dovuta all’effetto dell’attività solare
- variazioni climatiche.
ancora verificato se l’attività solare produca queste variazioni che, a loro volta, influenzano le concentrazioni di 14C o se il Sole influenzi direttamente dette concentrazioni, senza passare per le variazioni climatiche. L’indicatore di variazione della concentrazione di 14C nel tempo è detto Δ14C: 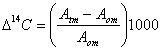 .
.
In questa formula Atm è l’attività della riserva, corretta per il frazionamento isotopico, e Aom è l’attività per uno standard..
Tener conto di queste correzioni non è, però, sufficiente poiché l’età del reperto non può considerarsi assoluta; è necessario calibrarla.
Sono stati individuati dei materiali che conservano traccia della concentrazione di 14C nell’atmosfera dei quali è nota l’età.
Per questo motivo è risultato utile ricorrere alla dendrocronologia, ovvero alla tecnica di datazione che si basa sul conteggio degli anelli di accrescimento dei tronchi degli alberi.
In tal modo si è entrati in possesso di una curva di calibrazione per il 14C che negli ultimi anni è stata ulteriormente migliorata ricorrendo alla datazione dei coralli e al metodo Uranio Torio.







 Dalla precedente relazione, assumendo che C0 e t siano noti e misurando C(t) si ricava
Dalla precedente relazione, assumendo che C0 e t siano noti e misurando C(t) si ricava 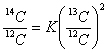 essendo K una costante di proporzionalità.
essendo K una costante di proporzionalità.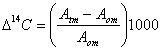 .
.




Inviato da: Lare_il_silenzio
il 09/10/2012 alle 11:23
Inviato da: nagal56
il 06/10/2012 alle 17:17
Inviato da: Lare_il_silenzio
il 06/09/2012 alle 14:04
Inviato da: gin_ko1957
il 06/09/2012 alle 11:04
Inviato da: nefereth
il 14/08/2012 alle 15:06