La volta scorsa in chiusura di post avevo accennato ai fiammiferi che Jean Chancel inventò allo sbocciare del diciannovesimo secolo.
Sai che bello poter avere qualcosa che potesse produrre il fuoco immediatamente quando voluto, economicamente e senza nessuna fatica!
Sembra una sciocchezza detto oggi... ma quanto c'è voluto per arrivarci? Dall'età della pietra fino al 1805.
Naturalmente poi l'evoluzione di questa geniale invenzione che portava il fuoco in tutte le tasche è continuata fino al secolo successivo.
Ma perchè si accendevano i fiammiferi di Chancel?
Intanto diciamo come erano fatti. Si trattava semplicemente di una asticciola di legno leggero e facilmente infiammabile con una capocchia fatta di una miscela di clorato di potassio, zucchero e colla.
Più o meno (in senso lato) come quelli attuali.
Solo che non si accendevano sfregandoli ma immergendone un attimo la testina in acido solforico.
(E aggiungo: sai che bello andare in giro con in tasca una boccettina di H2SO4 concentrato! Ma c'era chi lo faceva; del resto le nuove invenzioni non nascono già perfette, no? In questo caso riguardo i fiammiferi si trattava certamente della Release 1.0 e tutto è perdonato).
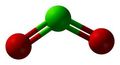
Se si getta qualche cristallino di KClO3 (ho detto qualche cristallino, non una punta di spatola...) in una provetta contenente un paio di ml di H2SO4 concentrato si sentirà un crepitio e si vede svilupparsi un colore giallo limone, dovuto al gas biossido di cloro ClO2.
Il clorato nell'acido solforico genera dell'acido clorico HClO3, che nell'ambiente di reazione si scompone istantaneamente secondo la reazione:
3 HClO3 --> HClO4 + 2 ClO2 + H2O
si forma per dismutazione acido perclorico, molto più stabile, e biossido di cloro gassoso.
Questo gas è terribilmente instabile e si decompone con straordinaria facilità esplodendo appena può farlo (ecco spiegati i microcrepitii che si sentivano nella provetta di prima).
Si decompone di certo, e lo fa con enorme piacere, in presenza di sostanze organiche, qualunque esse siano.
Se guardate su Youtube vedrete che è pieno di fiamme generate dalla chancelliana miscela di clorato e zucchero, accesa dalla goccia di acido solforico.
Ma si tratta di esperimenti inflazionati e grossolani che non mi piacciono particolarmente.
Allora, nella boccetta che tiene in tasca, avviene proprio una bella reazione quando Monsieur Chancel vi immerge il legnetto!
Abbiamo: clorato di potassio (ossidante per eccellenza), zucchero (sostanza organica combustibile), acido concentrato e biossido di cloro appena formato (suscettibile per eccellenza).
Volete che quest'ultimo non inneschi l'accensione di quella sensibile miscela comburente/combustibile? Infatti alla grande se l'innescava! E la capocchia prendeva fuoco appena sfiorata dall'acido.
L'avrebbe fatto anche il legnone del mio amico, anche se refrattario ad ogni strofinio...
Il biossido di cloro si usa tutt'ora in notevoli quantità, diluitissimo in acqua o in gas (e allora non è pericoloso) come sbiancante per la polpa di legno e come disinfettante, ma lascio alle solite ricerche in rete per chi vuole approfondire.
In laboratorio lo si può prepare con minor pericolo (!) riscaldando leggermente una soluzione di una parte di KClO3 e 4,5 parti di acido ossalico in acido solforico diluito 1:3 - Si sviluppa anche anidride carbonica che diluisce il gas e lo rende più gestibile.
Vi sono altri metodi di perparazione (ved.), ma non sono esperimenti da fare con leggerezza, lo dico solo per completare queste due parole sul protagonista di oggi.
Questo gas si comporta come anidride mista in reazione con gli alcali e dà clorati e quei misteriosi sali che sono i cloriti, per es. KClO2.
2 KOH + 2 ClO2 --> KClO3 + KClO2 + H2O
Misteriosi nel senso che sono usati solo industrialmente e di solito nelle esperienze di lab non se ne parla se non del tutto eccezionalmente.
Quel meraviglioso libro di inorganica "storica" che è il mio vecchio Bruni aggiunge che una miscela di biossido di cloro e tricloruro di fosforo è chemioluminescente... che altro volere da questo permalosissimo gas che dice "guardatemi ma non toccatemi"?
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58