Ahi, ahi, che titolo pretenzioso per una ciambellina senza buco!
Come si sa, ogni tanto piazzo qui anche le ciambelle mal riuscite e questo è uno di quei casi, fortunatamente non troppo frequenti, ma che è giusto documentare.
Ma partiamo dall'inizio.
Come ho detto qualche volta, mi piacciono i composti organici contenenti lo zolfo ed in modo speciale quelli che al posto del gruppo alcolico -OH hanno quello tiolico -SH; riscorrendo il libro di Gian Maurizio Reiner "Sintesi ed applicazioni dei reagenti organici" (Hoepli 1953) mi sono imbattuto (per l'ennesima volta) nella sintesi dell'acido tioglicolico, sintesi per la quale avevo comodi i reagenti.
-Questa volta lo faccio!- ho pensato, e così è stato... almeno nelle intenzioni.
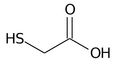
L'acido tioglicolico (o meglio il vecchio "mercaptoacetico", che ricorda con più forza il puzzolente gruppo -SH) ha la semplice formula HS-CH2-COOH, dove un idrogeno metilico dell'acido acetico è sostituito non dall'-OH (acido glicolico) ma dall'-SH di cui sopra.
Per farla breve, riassumo quanto dice il Reiner riguardo le caratteristiche e la procedura di sintesi.
L'acido tioglicolico è un liquido maleodorante (e non poteva essere altrimenti) bollente a 108° a 16 mmHg, solubile in acqua e nei comuni solventi, stabile allo stato di sali; all'aria si ossida facilmente ad acido ditioglicolico HOOC-CH2-S-S-CH2-COOH e forma alcuni sali poco solubili, come quello d'argento e di bario (circa 1% in acqua a 20°).
Si prepara (o devo dire: si preparerebbe?) come segue:
-50 g di acido monocloroacetico Cl-CH2-COOH vengono sciolti in 25 ml di acqua ed a soluzione ottenuta, sotto buona agitazione, vengono aggiunti goccia a goccia 480 ml di una soluzione al 15% di potassio solfidrato KHS.
Terminata l'aggiunta si scalda a b.m. a 70-80° e si aggiunge alla soluzione calda una soluzione concentrata di 122 g di bario cloruro BaCl2.2H2O contenente 46 ml di ammoniaca al 25%.
Si raffredda e si lascia cristallizzare per 3-4 ore, aiutando la cristallizzazione con lo sfregamento delle pareti del becher con una bacchetta di vetro.
Vecchi sistemi ancora validi, e così ho fatto.
Unica variazione alla procedura (oltre a dividere per 10 le quantità) è stata la sostituzione del solfidrato di potassio con quello di sodio, NaHS, aggiustandolo secondo stechiometria (5,6 g contro 7,2).
La reazione bruta è semplice: il gruppo -SH del sale va a sostituire il cloro dell'acido formando cloruro alcalino e ac. mercaptoacetico, poi precipitato come sale di bario poco solubile.
Tutto bello in teoria, ma la sorpresa è stata che il sale di bario precipitato...è stato solo 0,7 g!
Me ne aspettavo una quantità superiore almeno di un ordine di grandezza e ritengo che l'aver sostituito il sodio con il potassio sia del tutto ininfluente.
E allora? Da cosa è dipeso questo irrisorio rendimento, da non meritare nemmeno una foto?
Finora non lo so; bisognerebbe che qualche altro sperimentatore volonteroso replicasse la sintesi, ma in questi tempi di "Chimici sperimentali da tastiera" ciò appare assai improbabile.
Ma non dispero... butto l'amo nella ciotolina.
Ora dovrei, per completare la sintesi, trattare il tioglicolato di bario con acido solforico, precipitare e separare il BaSO4 (questo sarebbe banale), estrarre l'acido organico reso libero con etere, evaporare l'etere e distillare a pressione ridotta il tioglicolico... così, tanto per vedere che faccia ha e se davvero spande nell'aria i suoi odorosi -SH
Ovviamente con meno di un grammo di sale di bario la questione nemmeno si pone perchè la resa finale sarebbe esattamente uguale a zero.
E allora mi tengo come ricordino un pizzico di mercaptoacetato di bario, che come dimensioni non è certo una ciambella ma almeno un biscottino microscopico testimone di qualcosa da appurare.
Prima ipotesi: ho commesso qualche errore durante la procedura? Può essere.
Seconda ipotesi: colpa del Reiner che ha riportato una procedura non ben collaudata? Meno probabile, ma può essere.
I tioglicolati, per la loro azione su peli e capelli (rompono i ponti disolfuro della cheratina) sono usati sia come prodotti nelle composizioni per le "permanenti" delle signore (sale di ammonio) sia come agenti depilatori nell'industria della concia delle pelli (sale di di calcio).
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58