CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
| « Sintesi della Crisoina | Corrosione elettrochimica » |
|
Post n°113 pubblicato il 24 Giugno 2011 da paoloalbert
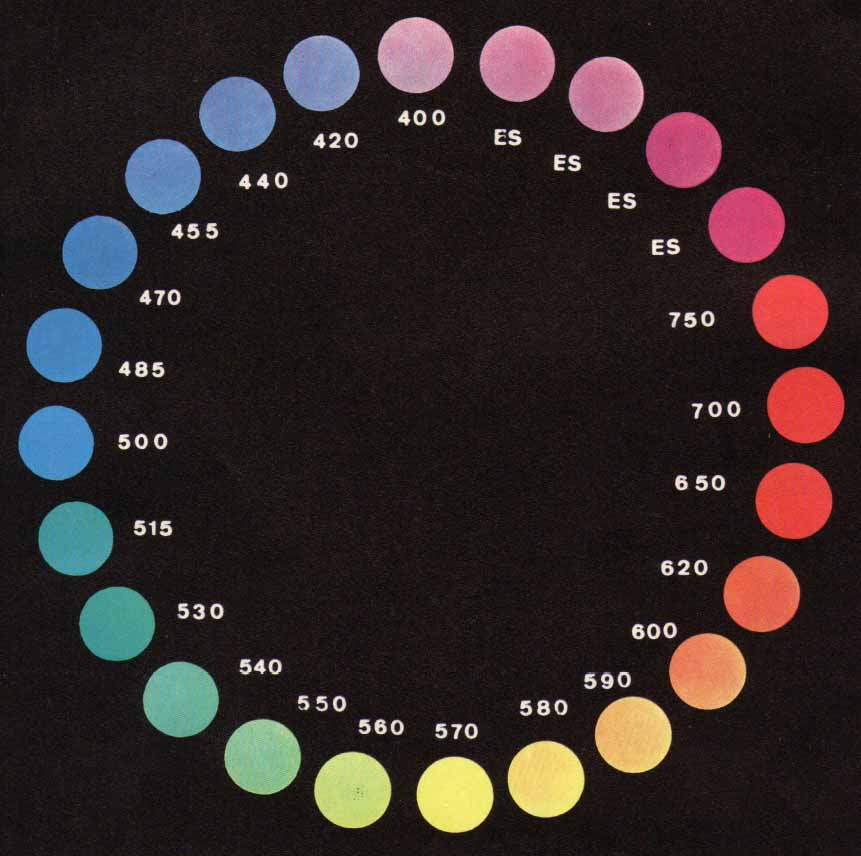
A proposito della crisoina dell'altra volta, e parafrasando un noto presentatore, si potrebbe dire che "sorge spontanea una domanda": perchè questa sostanza è un colorante e mille altre non lo sono?
Siccome l'occhio umano non è in grado di distinguere i vari colori quando viene colpito contemporaneamente da radiazioni di λ diversa, oltre ai colori "puri", esistono infinite combinazioni diverse, che danno la sensazione della tonalità cromatica a seconda dell'assorbimento più o meno selettivo da parte della sostanza colorata. La presenza di una particolare struttura e di certi raggruppamenti atomici nella molecola di un composto chimico conferisce la capacità di assorbire selettivamente luce visibile e rendere quel composto colorato. Succede che se in una molecola sono presenti doppi legami coniugati (-C=C-C=C-) gli elettroni risultano maggiormente delocalizzati, con conseguente ulteriore diminuzione energetica tra un livello e l'altro e più facile eccitabilità da parte di una radiazione visibile. La vecchia teoria classica di Witt (più intuitiva in un semplice contesto come questo) affema che una molecola per apparire colorata deve possedere almeno un gruppo "cromoforo" e percolorare almeno un gruppo "auxocromo". :C=C: etilenico Un auxocromo permette sia la fissazione del colorante ad un substrato sia di aumentare la λ della radiazione assorbita rendendo colorata una molecola che senza di esso assorbirebbe nell'UV, oppure di spostare verso il rosso la tonalità (diverso effetto di una stessa causa). Per concludere queste semplici riflessioni, torniamo alla crisoina e verifichiamo: -c'è il fondamentale gruppo -azo? Sì! Jawohl! esclama allora Herr Otto Witt,... perchè mai la crisoina non avrebbe il sacrosanto diritto di farti una bella macchia gialla sulla camicia?
|
https://blog.libero.it/paoloalbert/trackback.php?msg=10358919
I blog che hanno inviato un Trackback a questo messaggio:
MENU
ULTIMI COMMENTI
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58