CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Gennaio 2011
|
Post n°76 pubblicato il 28 Gennaio 2011 da paoloalbert
Ambientandoli in periodo vittoriano, ho parlato poco tempo fa di certi singolari avvelenamenti il cui colpevole era il verde di Parigi. Chimicamente questo composto colorante è un sale di rame e sappiamo che quasi tutti i sali di rame o sono azzurri o sono verdi. Un pigmento per essere utilizzabile deve essere del tutto insolubile in acqua e per quanto possibile inalterabile nel tempo, quindi in pratica i sali di rame effettivamente adatti allo scopo sono molto pochi. Molto simile al verde di Parigi è il verde di Scheele, al quale manca però la componente acetica ed è pertanto arsenito di rame CuHAsO3; anch'esso non ha sempre una ben definita composizione poichè i rapporti tra arsenico, rame e molecole d'acqua legate dipendono dal metodo di preparazione. In ambito artistico era uno dei verdi preferiti da Cezanne, Van Gogh e altri artisti di quella splendida età pittorica che fu l'impressionismo.
Lo accompagno volentieri con un quadro di Cezanne e uno di Monet, nei quali, ci giurerei, l'acetoarsenito di rame è il protagonista fondamentale. E poi dicono che la Chimica e l'Arte non vanno d'accordo...
|
|
Post n°75 pubblicato il 23 Gennaio 2011 da paoloalbert
In un laboratorio di chimica sperimentale bene organizzato, i reagenti (quelli che le persone comuni chiamano "le sostanze"), dovrebbero essere talmente numerosi da rasentare l'assurdo, per permettere (almeno in teoria) di progettare una qualsiasi reazione che capitasse di dover fare.
Materiale necessario: - Potassio nitrato KNO3 Stavolta occorre fare una sottolineatura sul termine "opportuna": la vetreria deve essere categoricamente "normalizzata", ovvero di qualità e con tutti i giunti di vetro smerigliato di dimensioni standard, per assicurare una tenuta perfetta; niente deve essere di gomma, plastica o materiali non resistenti alla potentissima aggressività dell'acido nitrico concentrato. La semplice reazione da sfruttare sarà la seguente: KNO3 + H2SO4 --> KHSO4 + HNO3 - In un pallone da 500 ml introdurre 100 g di KNO3 e 100 ml (184 g) di H2SO4 concentrato. L'acido solforico è in grande eccesso (quasi il doppio) rispetto alla quantità stechiometrica e serve per trattenere il più possibile l'acqua derivante dalla decompozione dell'acido nitrico. Agitare brevemente il pallone e chiudere immediatamente predisponendo il tutto per la distillazione, con adatto termometro e refrigerante Liebig.
Il peso di 10 ml esatti è stato di 15 g, quindi l'acido ottenuto in questo modo ha densità 1,5 - corrispondente ad una concentrazione del 96%, esattamente come mi ero proposto di ottenere.
Quest'acido mi è poi servito per la nitrazione dell'anidride ftalica (ved. luminol); il rimanente servirà per altre nitrazioni toste, nei casi in cui è difficile introdurre un nitrogruppo -NO2 in una molecola se non si ha a disposizione HNO3 quasi al 100%.
|
|
Post n°74 pubblicato il 16 Gennaio 2011 da paoloalbert
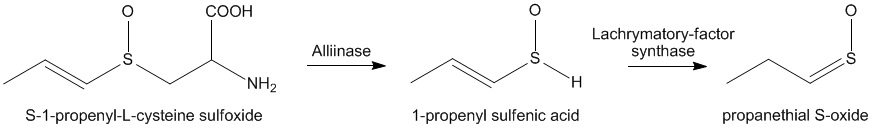
In questo blog capita talvolta uno strampalato "chef" chimico che va a preparare le sue indigeste ricette (magari a base di 2-naftalensulfonato sodico o peggio!) e poi tenta di propinarle a quei benevoli commensali che si prestano agli esperimenti, non so con quanto successo... Ecco, e te pareva! dirà qualcuno, vedrai che ricadiamo inesorabilmente nella chimica e adesso salterà fuori la storia del perchè la cipolla fa piangere chi la taglia. Allora, veniamo al sodo, perchè si piange? (Spero sia sottinteso che non si intende "zolfo" in quanto elemento, ma che esso è combinato chimicamente a formare sostanze con caratteristiche peculiari che con l'elemento non hanno niente a che vedere. Ma quella particolare molecola di cui dicevo non è sufficiente: ci vuole qualcos'altro, tipicamente biologico.
Successivamente questa sostanza per rapido riarrangiamento (riarrangiamento si ha quando in una molecola cambiano di posto certi atomi o gruppi di atomi rispetto alla posizione di partenza) porta alla formazione di... (rullino i tamburi): Questa tioaldeide è un gas reattivo e irritante, che stimolando i neuroni sensoriali degli occhi agisce come un agente di lacrimazione e di bruciore, al quale reagiscono le ghiandole lacrimali generando liquido allo scopo di tentare di diluire il fastidioso agente chimico estraneo. Ci sono vari e più o meno fantasiosi consigli per cercare di evitare questo piccolo inconveniente a cui va incontro ogni brava massaia alle prese con un soffritto di cipolla; sono consigli che magari si provano una volta ma che poi nessuno per fretta e semplicità mette in pratica. Quindi vai tranquillo cuoco: zac-zac-zac, una bella affettatina senza starci proprio sopra con gli occhi, olio quanto basta, uno spicchietto d'aglio e un rametto di rosmarino... e lasciamo pure che il povero propanetiale sulfossido tenti anche lui di fare il lavoro di difesa per il quale è stato creato. |
|
Post n°73 pubblicato il 15 Gennaio 2011 da paoloalbert
Bando alle ciance, oggi lo chef ha un raptus hard e propone a tutti i commensali un piatto di chimicaccia da stomaco buono:
Veniamo subito al sodo, ecco cosa occorre: - in un pallone a due colli da 250 ml con applicato imbuto separatore e termometro che tocca quasi il fondo, introdurre 50 g di naftalina finemente macinata e riscaldare prima fino a fusione (80°) e poi piano piano fino a raggiungere la T di 160° (tolleranza di più o meno 5 gradi). Lasciar raffreddare e versare il prodotto in un becker da un litro contenente 500 ml di acqua, mescolando.
That's all folks! Non è il caso di dire buon appetito... a meno che non ci sia in giro qualcuno che si chiama Eta Beta. |
|
Post n°72 pubblicato il 08 Gennaio 2011 da paoloalbert
Se dico "vittoriano", non vien subito da pensare a quel romantico periodo a cavallo tra la prima metà e la fine dell'ottocento? C'è da dire che le pareti delle case borghesi (specialmente inglesi) erano allora spessissimo ricoperte dalla tappezzeria, la cosiddetta "carta da parato": bene, facciamo finta ora che alla padrona di casa di una ipotetica dimora signorile del tempo piacesse una tappezzeria vivace, magari ad artistici fiorami, foglie e fregi come era di moda... Poteva capitare, ed è effettivamente capitato in tante occasioni, che i signori abitanti di quella certa casa cominciassero ad avere strani sintomi, magari all'inizio semplici starnuti, poi tosse, lacrimazione, mal di gola, nausea, coliche, spasmi muscolari, diarrea, depressione, estrema debolezza... La fabbrica della carta da parati aveva usato per i propri pigmenti il bellissimo verde di Parigi (detto anche verde di Schweinfurt) oppure il verde di Scheele, due composti arsenicali allora molto in uso. Qualche formuletta si impone per capire meglio quella vittoriana tappezzeria: - As, sua maestà l'Arsenico, un grigio semimetallo; è sempre lui il colpevole per definizione, è come il maggiordomo dei gialli delle barzellette! Dopo queste amene considerazioni di tossicologia pre-ecologica, quando la sensibilità ambientale era zero con tutte le sue ovvie conseguenze, ce ne sarebbero da fare altre, ma girate di 180 gradi, verso un altro estremismo.
|
|
Post n°71 pubblicato il 04 Gennaio 2011 da paoloalbert
Accendo ora il computer e mi accorgo che il "contachilometri" ha intanto doppiato quella che per me era una lontanissima boa. Non so chi sarà stato il decimillesimo ospite di questo blog nato quasi per caso giusto un anno fa... è certo che per chi trova un po' di diletto anche nello scrivere (oltre che nello sporcare provette!) è una buona soddisfazione constatare che qualcuno apprezza, o almeno partecipa benevolmente a quanto si fa e a quanto si dice. Auguri rinnovati a questo ignoto decimillesimo amico! |
|
Post n°70 pubblicato il 01 Gennaio 2011 da paoloalbert
|





 Tutto deve potere essere svolto con la massima tranquillità e sicurezza.
Tutto deve potere essere svolto con la massima tranquillità e sicurezza.
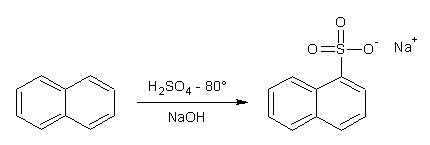
 Lasciando raffreddare si ha abbondantissima separazione di
Lasciando raffreddare si ha abbondantissima separazione di  Il 2-naftalensulfonato sodico
Il 2-naftalensulfonato sodico 

Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58