CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Agosto 2011
|
Post n°126 pubblicato il 31 Agosto 2011 da paoloalbert
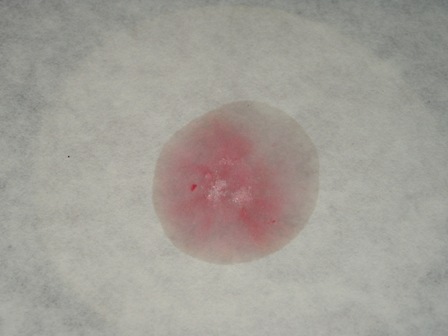
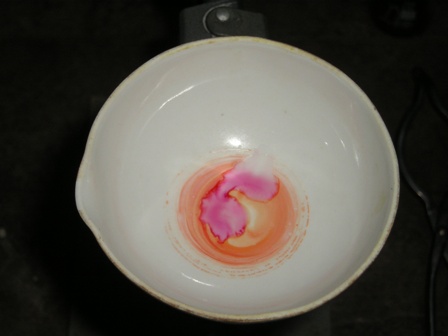
Eccoci finalmente alla fase sperimentale del saggio della muresside: cosa ci serve?
- porre in una capsula una piccola puntina di spatola di caffeina con circa 4-5 volte il suo peso di clorato di sodio o potassio, mescolare e ricoprire la miscela con un paio di ml di HCl concentrato.
Test 2 - porre in una capsula una piccola puntina di spatola di caffeina e aggiungere 1 ml di HCl al 10% e 1 ml di acqua ossigenata al 30%.
Come si vede il test viene benissimo e la colorazione purpurea è molto evidente; chi non avesse a disposizione la caffeina potrebbe estrarne un po' dal tè (anche senza purificarla) e fare un test ancora più "ruspante" sul prodotto alimentare: oso sperare che qualche anonimo e incognito volontario prima o poi lo farà. |
|
Post n°125 pubblicato il 29 Agosto 2011 da paoloalbert
Quando (è passato un bel po' di tempo?) frequentavo con gli amici di scuola il laboratorio di chimica organica, ogni tanto usciva da parte di qualcuno la battuta:
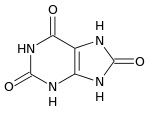
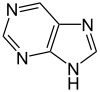
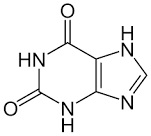
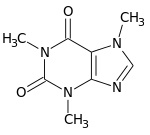
Acido urico Purina Xantina per esempio il derivato trimetilico della xantina è la notissima caffeina del caffè
che con le sorelle quasi gemelle teobromina (del cacao) e teofillina (del tè) costituiscono le cosiddette basi xantiniche.
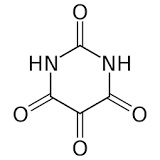
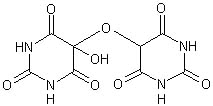
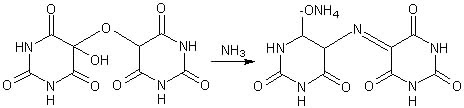
Allossana Acido dialurico i quali possono condensare per formare alloxantina
A sua volta l'alloxantina, in presenza di ammoniaca, forma il sale d'ammonio dell'acido purpurico intensamente colorato in rosso purpureo, detto finalmente... muresside!
E' interessante notare che tutti questi nomi pittoreschi dei derivati dell'acido urico vennero scelti per la maggior parte da Wohler e Liebig secondo particolari ragionamenti in un tempo in cui era quasi impossibile intuirne le strutture ed il metodo per determinare il contenuto di azoto era così soggetto ad errori da dare risultati incerti. |
|
Post n°124 pubblicato il 21 Agosto 2011 da paoloalbert
L'ottavo Carnevale della Chimica, ospitato questa volta sul blog Knedliky ha come tema "La chimica delle sostanze bioattive": quale migliore occasione per provare e riferire un paio di test qualitativi che avevo in mente da una montagna di tempo?
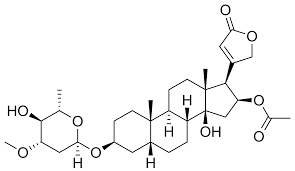
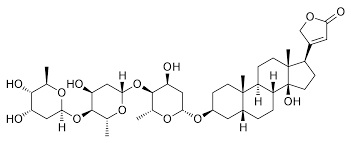
Da noi, ed in tutto il Mediterraneo, non c'è persona che non sappia che l'oleandro è una pianta velenosa; certo non dev'essere così dappertutto perchè sembra che specialmente in Sud Africa, dove questa bella pianticella non è autoctona, vi sono molti casi di avvelenamento, soprattutto fra i bambini (la fame dev'essere tanta per riuscire a biascicare queste amarissime foglie...).
L'oleandrina pura si presenta come una polvere bianca cristallina, insolubile in acqua, molto amara. Nella pianta dell'oleandro, specialmente nelle foglie, è contenuta per circa lo 0,08% -
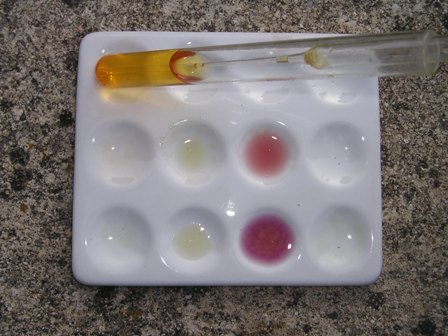
Test n. 1:
Test n. 2
Foto sopra: nel pozzetto a sinistra soluzione diluitissima di oleandrina in etanolo ---°°°OOO°°°--- |
|
Post n°123 pubblicato il 19 Agosto 2011 da paoloalbert
Ecco un altro piccolo intermezzo, facile facile, scaturito giocando d'estate con i sali di cobalto.
sol. di acetato di cobalto complesso con KOCN oppure diluizione con acqua oppure aggiunta di etanolo.
Come dicevo all'inizio, giochetti estivi di poco impegno! |
|
Post n°122 pubblicato il 13 Agosto 2011 da paoloalbert
E' incredibile come la mente possa, partendo da uno stimolo qualsiasi, mettersi a girovagare in un milione di agganci, solo con un po', diciamo così, di "predisposizione".
per pura curiosità e a mio rischio e pericolo metto pure il nome ufficiale IUPAC:
Come per ogni sostanza, prima di esprimere spicce considerazioni qualitative, approfondiamo l'argomento sulla tossicità della sostanza medesima dal punto di vista quantitativo (la DL50 e la quantità effettivamente ingerita sono i dati che contano!) e poi traiamone le personali conclusioni.
|
|
Post n°121 pubblicato il 05 Agosto 2011 da paoloalbert
Se tu non fossi proprio giovanissimo e qualcuno ti dicesse: pensa ad un insetticida antimosche, antizanzare, antitutto... pensa ad un classico insetticida da dare con il vecchio spruzzatore a pompetta... tu a cosa penseresti? Tempo di riflessione mezzo secondo: al DDT!
Materiale occorrente: La miscela diventa subito leggermente lattiginosa; mescolare sempre per un'ora circa e poi lasciar riposare fino al giorno successivo, con tappo ermeticamente chiuso. Ricristallizzare il prodotto da alcol isopropilico (80 ml isopropanolo + 20 ml acqua) e lasciar raffreddare lentamente. Filtrare e seccare all'aria.
Resa 3,3 g (circa 46%) di DDT, compresa la discreta quantità dei suoi isomeri (il cloro è in -p, in -o e mix). |











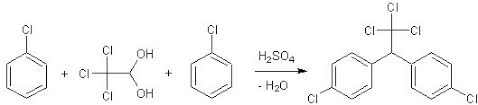
 In una beuta da 100 ml con tappo smerigliato, porre
In una beuta da 100 ml con tappo smerigliato, porre  Mescolare ancora e lasciar riposare ulteriori 4 giorni o anche più, mescolando ogni tanto il liquido giallino torbido.
Mescolare ancora e lasciar riposare ulteriori 4 giorni o anche più, mescolando ogni tanto il liquido giallino torbido. 
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58