CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Settembre 2011
|
Post n°131 pubblicato il 30 Settembre 2011 da paoloalbert
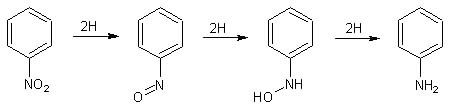
In ambiente acido e fortemente riducente, i nitrocomposti aromatici portano alla formazione della corrispondente ammina; è noto per esempio che il classico metodo di produzione dell'anilina parte dal nitrobenzene che viene ridotto con ferro e acido cloridrico diluito.
la reazione procede dal nitrobenzene, al nitrosobenzene, alla fenilidrossilammina, all'anilina. - In un becker da 250 ml, sciogliere 6 g di NH4Cl in 250 ml di acqua e aggiungere 12 g (10 ml) di nitrobenzene.
L'impiego sicuramente più interessante che se ne potrebbe fare è la sintesi del Cupferron, partendo dalla fen.idr.amm. appena prodotta. Comunque sarebbe un bellissimo reattivo per il rame e per il ferro, ma la sua sintesi presuppone l'impiego di grandi quantità di ammoniaca gassosa proveniente da bombola e quindi tale lavoro è del tutto improponibile per un home-lab. Conclusione: accontentiamoci di vederla per un po', questa fenilidrossilammina, poi una volta nella sua bottiglietta sarà libera di degradarsi a tutto ciò che vorrà, senza alcun rimpianto da parte mia. |
|
Post n°130 pubblicato il 19 Settembre 2011 da paoloalbert
Il tema del Carnevale chimico di settembre, ospitato questa volta da Teresa Celestino sul suo blog Urto Efficace, invita a fare --> |
|
Post n°129 pubblicato il 14 Settembre 2011 da paoloalbert
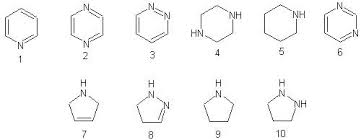
Anche nelle famiglie chimiche succedono cose strane. Ma di cosa stai parlando? Son vaneggiamenti? Niente paura, sto parlando di quell'infornata di sostanze eterocicliche i cui nomi sembrano studiati apposta per far confusione; sfido trovare qualcuno che -tic, tac- sappia sparar fuori tutte le formule giuste, senza incertezze, delle sostanze che dirò. Ricordo intanto per qualche lettore volonteroso che in chimica organica sono cicliche quelle sostanze la cui formula è formata da un poligono, come un serpente che si mangia la coda, ed eterocicliche quelle che hanno intercalato nell'anello della formula anche un elemento diverso dal carbonio. Ecco il campionario delle gemelle PI, spero ci siano tutte le più importanti. Naturalmente faccio questo elenco soprattutto per me, perchè faccio sempre confusione e mai son riuscito (nè mai riuscirò...) ad impararle tutte.
1- Piridina 2- Pirazina 3- Piridazina ... e sotto ci sono quelle con l'anello pentagonale: 7- Pirrolina 8- Pirazolina Le ho messe solo in ordine di "assonanza", niente a che vedere con somiglianze chimiche, aromaticità o quant'altro. - con la pirrolina ci sta il pirrolo... ma ci prova anche il pirrolidone! Visto che ci siamo, vogliamo dare una sbirciatina a qualche appartamento di questo strano condominio, anche se sul campanello il nome non comincia sempre con PI? C'è qualche famigliola moderna, "con gli anelli condensati", e qualche piccola trasgressione... - App.1: l'indolo con l'indolina
Basta! basta! ero partito con l'idea di fare un po' di ordine e mi trovo più confuso di prima! |
|
Post n°128 pubblicato il 10 Settembre 2011 da paoloalbert
Ogni tanto accenno nel blog a quelli che io chiamo "sporcaprovette", cioè a quegli strani individui che hanno come hobby la chimica sperimentale.
Una volta filtrato, possiamo tenere anche questo prodotto bianco cristallino in quantità recuperabile (1 g). Porre il filtrato in una beuta su agitatore magnetico e aggiungere 16 ml di acetone, lasciando mescolare per 4-5 ore per favorire la formazione dell'acetone semicarbazone sotto forma di un precipitato bianco lattiginoso.
Raffreddando in ghiaccio, aggiungere 15 ml di etanolo ed altrettanti di etere, mescolando bene; la semicarbazide cloridato precipita sotto forma di polvere bianca cristallina.
La semicarbazide è un reagente per aldeidi e chetoni perchè forma prodotti di condensazione cristallini con un p.f. ben definito e facilmente separabili, che possono poi rigenerare il prodotto carbonilico per idrolisi acida.
|
|
Post n°127 pubblicato il 06 Settembre 2011 da paoloalbert
Oggi ho perso definitivamente uno dei più fedeli, anzi, il più fedele fra i lettori del mio blog. |







Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58