CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Dicembre 2012
|
Post n°213 pubblicato il 26 Dicembre 2012 da paoloalbert
Alla fine del 2012 il transistor compie 65 anni.
Da quando Brattain, Bardeen e Shockley dei Bell Labs hanno appoggiato un paio di aghetti d'oro su una piastrina di germanio ottenendo un minuscolo triodo senza filamento e capace di amplificare, il mondo si è incamminato a rotta di collo verso un altro mondo, sempre più microscopico. La legge di Moore, dagli anni '70, afferma che le prestazioni di un microprocessore (il Grande Moloch dei transistors) devono raddoppiare ogni anno e mezzo; il mio primo PC del 1987 (un 8088) era un vero morto di fame: aveva nel "core" solo 29mila semiconduttori...
|
|
Post n°212 pubblicato il 21 Dicembre 2012 da paoloalbert
|
|
Post n°211 pubblicato il 15 Dicembre 2012 da paoloalbert
Ognuno ha le sue preferenze, perfino per i personaggi del Teatro mendeleeviano... Fisicamente è un metallo molto tenero, lucente, simile all'argento. |
|
Post n°210 pubblicato il 09 Dicembre 2012 da paoloalbert
Quand'ero bambino sono sicuro che il giorno di Santa Lucia era il più bel giorno dell'anno. Ora, nel secolo successivo, non è più così per la maggior parte dei bimbi; se son troppo piccoli non ragionano sulle date e se sono appena un pelino più grandi non han certo da aspettare le ricorrenze annuali... le occasioni (spesso pretestuose) sono anche troppe tra un dicembre e l'altro. E così anche i regali vanno a subire l'inesorabile effetto della diluizione... ubi major, minor cessat... come il valore dei medesimi, vittime essi stessi di inflazione per sovradosaggio. Qui da noi, nella mia città e provincia, quando eravamo bambini "Santa Lucia" e "giocattoli" erano entità inscindibili e sinonime; una tanto rara, quanto gli altri tanto preziosi ad un tempo!
A U G U R I D I S A N T A L U C I A
|
|
Post n°209 pubblicato il 06 Dicembre 2012 da paoloalbert
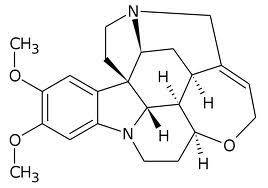
Già che siamo in tema di alcaloidi "antichi" e dopo aver chiacchierato un po' con la scorbutica coniina, perchè non ridare un attimo di gloria anche ad un'altra vecchia protagonista della chimica?
- una "nitrata" artificialmente
Recitata la sua parte con onore, la signorina brucina si è rimessa il soprabito bianco ed è tornata modestamente nel suo camerino, dove vive da tempo immemorabile. |






Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58