CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Giugno 2011
|
Post n°115 pubblicato il 30 Giugno 2011 da paoloalbert
Oggi ho deciso di ripassare (queste note le scrivo essenzialmente per me...) la classificazione dei coloranti organici secondo la costituzione chimica, cioè in funzione dei gruppi cromofori presenti nella sua molecola o in funzione della struttura.
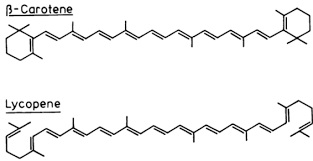
-COLORANTI ETILENICI: contengono il cromoforo etilenico -CH=CH- più volte ripetuto. Importanti in questo gruppo sono i carotenoidi del mondo vegetale: ecco le formule del β-carotene (in alto, giallo) delle carote e del licopene (in basso, rosso) dei pomodori, con la loro bellissima e chilometrica serie di doppi legami coniugati.
-COLORANTI NITROSO E NITRO: si ottengono nitrosando o nitrando fenoli o naftoli e quindi contengono i gruppi -NO ed -NO2, associati al gruppo ossidrile. Formano facilmente dei complessi di coordinazione con alcuni metalli, generando lacche insolubili che si fissano al substrato. Un esempio è l'α-nitroso-β-naftolo che si colora in rosso legandosi col cobalto, con una sensibile reazione sfruttata in chimica analitica.
-COLORANTI DEL FIFENILMETANO: hanno il cromoforo chetoimminico C6H5-C(=NH)-C6H5, dove negli anelli aromatici appaiono anche gruppi attivanti in posizione para. Un esempio nei colori classici è il giallo auramina.
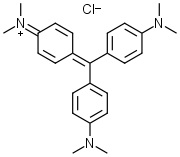
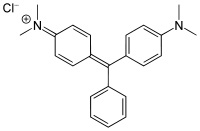
- COLORANTI DEL TRIFENILMETANO: si basano sui gruppi del fucsone (a sinistra) o della fucsoimmina (a destra), dove ai legami liberi del carbonio in alto vengono attaccati altri due anelli aromatici sostituiti in para con gruppi attivanti amminici (più o meno sostituiti) od ossidrili. Esempi noti sono il cristalvioletto ed il verde malachite, metilati nei due gruppi amminici.
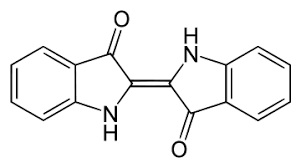
-COLORANTI INDIGOIDI: sono caratterizzati dal cromoforo in figura, dove X è un gruppo aromatico più o meno complesso. Naturalmente il colorante più importante di questa classe è l'indaco (naturale o artificiale). Il suo dibromoderivato (due atomi di bromo negli anelli benzenici) costituisce la famosa porpora di Tiro degli antichi.
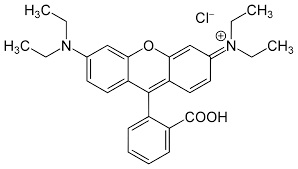
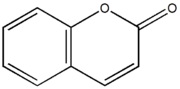
-COLORANTI XANTENICI: è una classe numerosa in cui è presente la molecola base xantene, poi variamente sostituita e resa più complessa.
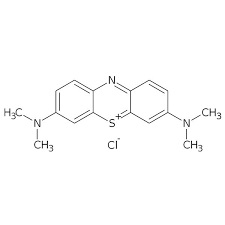
-COLORANTI OSSAZINICI E TIOAZINICI: contengono l'anello eterociclico azinico con un atomo di azoto sostituito da uno di ossigeno o di zolfo. Il più rappresentativo è forse il blù di metilene, figura, usato anche in istologia per le proprietà di colorare selettivamente tessuti cellulari.
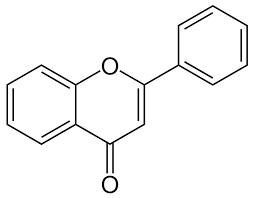
-COLORANTI FLAVONICI: dulcis in fundo, sostituendo variamente nel 2-fenilcromene (flavone),
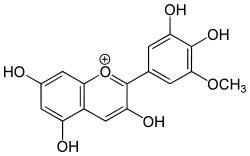
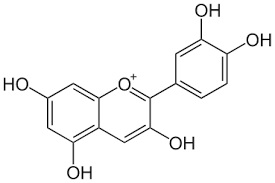
alcuni atomi di idrogeno negli anelli benzenici con gruppi alchilici o ossidrilici, si formano molti di quei colori che la natura fornisce ai fiori e ai frutti, ovvero le antocianine.
Al posto di un -R mettiamoci qualche -CH3 o qualche -OH e godiamoci il bellissimo colore risultante, come quello della cianidina, che dà il colore alle rose e ai fiordalsi e modifica il colore a seconda del pH della linfa... Magia della natura, magia della chimica!
L'elenco di cui sopra è sicuramente incompleto, e serve solo come prima veloce individuazione di un colorante organico in una classe definita. Se mi verrà in mente qualcos'altro scartabellando in giro o per qualche buon gradito suggerimento, lo aggiungerò. |
|
Post n°114 pubblicato il 26 Giugno 2011 da paoloalbert
Certi esperimenti costano tempo, denaro e fatica... certi altri non costano proprio nulla...
Ho lasciato semisepolto questo accrocco nella terra per nove mesi, ed ecco i risultati come si vedono in foto. Il rame naturalmente è intatto (a parte una ovvia ossidazione superficialissima) mentre il ferro si è corroso pesantemente, ricoprendosi nei punti non protetti dalla vernice di ruggine profonda (ossido idrato di ferro). Se non fosse stato a contatto del rame si sarebbe ossidato lo stesso, ma in maniera molto più leggera. |
|
Post n°113 pubblicato il 24 Giugno 2011 da paoloalbert
A proposito della crisoina dell'altra volta, e parafrasando un noto presentatore, si potrebbe dire che "sorge spontanea una domanda": perchè questa sostanza è un colorante e mille altre non lo sono?
Siccome l'occhio umano non è in grado di distinguere i vari colori quando viene colpito contemporaneamente da radiazioni di λ diversa, oltre ai colori "puri", esistono infinite combinazioni diverse, che danno la sensazione della tonalità cromatica a seconda dell'assorbimento più o meno selettivo da parte della sostanza colorata. La presenza di una particolare struttura e di certi raggruppamenti atomici nella molecola di un composto chimico conferisce la capacità di assorbire selettivamente luce visibile e rendere quel composto colorato. Succede che se in una molecola sono presenti doppi legami coniugati (-C=C-C=C-) gli elettroni risultano maggiormente delocalizzati, con conseguente ulteriore diminuzione energetica tra un livello e l'altro e più facile eccitabilità da parte di una radiazione visibile. La vecchia teoria classica di Witt (più intuitiva in un semplice contesto come questo) affema che una molecola per apparire colorata deve possedere almeno un gruppo "cromoforo" e percolorare almeno un gruppo "auxocromo". :C=C: etilenico Un auxocromo permette sia la fissazione del colorante ad un substrato sia di aumentare la λ della radiazione assorbita rendendo colorata una molecola che senza di esso assorbirebbe nell'UV, oppure di spostare verso il rosso la tonalità (diverso effetto di una stessa causa). Per concludere queste semplici riflessioni, torniamo alla crisoina e verifichiamo: -c'è il fondamentale gruppo -azo? Sì! Jawohl! esclama allora Herr Otto Witt,... perchè mai la crisoina non avrebbe il sacrosanto diritto di farti una bella macchia gialla sulla camicia?
|
|
Post n°112 pubblicato il 16 Giugno 2011 da paoloalbert
Dopo qualche divagazione "elettrostatica" (ma fatta con molta soddisfazione!) torniamo a noi, ovvero alla chimica sperimentale.
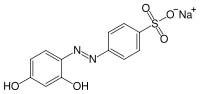
- Acido solfanilico p-NH2-C6H4-SO2-OH - In un becker da 100 ml sciogliere 2,5 g di acido solfanilico e 1 g di NaOH in 40 ml di acqua.
Lavare con soluzione satura di sale, aspirando bene per eliminare quanto più liquido possibile e poi essicare lentamente e con fatica all'aria.
La crisoina secca si presenta come una polvere color ruggine, discretamente solubile in acqua e in etanolo; tinge i tessuti in colore dai toni caldi dal giallo all'ocra ed è anche un indicatore di pH nel range basico 11-12,7 (giallo per pH <11 e rosso per pH >12,7
|
|
Post n°111 pubblicato il 11 Giugno 2011 da paoloalbert
Ecco la macchina di Van de Graaff completa!
(Una doverosa conclusione: da tempo il mio amico Guglielmo mi incoraggiava a fare questa macchinetta; siccome ora sta passando un periodo personale veramente difficile, a lui dedico questo lavoro). |
|
Post n°110 pubblicato il 08 Giugno 2011 da paoloalbert
Se è vero che alla fine tutti i nodi vengono al pettine, è arrivato finalmente al pettine anche questo nodo: la costruzione di una macchina Van de Graaff, che avevo in progetto da tempo immemorabile.
Motore e rullo inferiore Trasformatore per il motore
Cinghia e rullo superiore Il pettine interno alla sfera
Premetto subito che (a meno di non fare un modellino scalcagnato) non è una costruzione facile come forse potrebbe sembrare: una buona attrezzatura meccanica e precisione nell'esecuzione sono indispensabili. Come materiale per tutta la struttura, a parte la base di sostegno, ho usato il plexiglass, che è un materiale esteticamente bello e adatto per lavori in alta tensione ma è schifosamente scomodo da lavorare; tuttavia avevo deciso di usare questo e con questo ho proseguito. diametro in mm = tensione in kilovolt Il pettine inferiore per l'effetto corona è realizzato sagomando a punte un lamierino di rame; è singolare il fatto che il massimo rendimento si ottiene posizionandolo non in corrispondenza del rullo ma spostandolo una decina di cm più in alto, lungo il nastro. |
|
Post n°109 pubblicato il 04 Giugno 2011 da paoloalbert
Robert Jemison Van de Graaff nacque a Tuscaloosa, Alabama, il 20 dicembre 1901.
Nel 1935 V.d.G. ottenne il brevetto per la sua invenzione, destinata, oltre che come acceleratore di particelle, per la produzione di raggi X penetranti per la cura di tumori. "un dispositivo che ha permesso un immenso progresso nella ricerca nucleare". |
|
Post n°108 pubblicato il 01 Giugno 2011 da paoloalbert
Accennavo l'altra volta all'idiosincrasia mediatica verso la chimica e tutto il suo mondo, indotta da un'informazione e da una cultura scientifica media che non ardisco definire. State a sentire perchè la ballata è bella ed i protagonisti sono tanti e molto articolati... nelle loro ramificazioni laterali, se così vogliamo dire. Allora, nella bomboletta c'è dentro (maestro, vai con la musica):
Troppi perchè che non avranno mai una risposta. |
 e cambiando qualche ossidrile...
e cambiando qualche ossidrile...


 Il problema maggiore a questo punto è che la separazione, perchè la soluzione alcalina di crisoina e la
Il problema maggiore a questo punto è che la separazione, perchè la soluzione alcalina di crisoina e la  La maggior parte della
La maggior parte della 









Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58