CHIMICA sperimentale
Esperienze in home-lab: considerazioni di chimica sperimentale e altro
Messaggi di Febbraio 2011
|
Post n°82 pubblicato il 23 Febbraio 2011 da paoloalbert
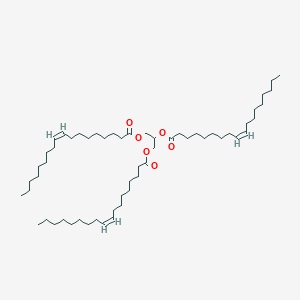
Chimicamente, di cosa è fatto l'olio di oliva? -glicerina: HO-CH2-CH(OH)-CH2-OH è un alcol trivalente, tre sono gli ossidrili -OH a disposizione per essere esterificati dagli acidi; ricordiamo che ad ogni ossidrile "si attacca" una molecola di acido eliminando una molecola di acqua. -acido oleico: CH3-(CH2)7-CH=CH-(CH2)7-COOH -acido palmitico: CH3-(CH2)14-COOH -acido linoleico: -acido stearico: CH3-(CH2)16-COOH Li ho elencati in ordine di abbondanza, tralasciando gli altri acidi presenti in quantità molto bassa (palmitoleico, linolenico, arachico, eicosenoico, beenico) e considerando sottinteso olio extravergine di oliva. L'acido oleico è presente in percentuale minima del 65%, ma supera di solito il 75%
Quei serpentelli rappresentano la catena di atomi di carbonio (dove c'è un angolo lì c'è un -CH2-) ed il nucleo centrale è la glicerina salificata con tre atomi di acido oleico. Osservare anche che due acidi (oleico e linoleico) hanno nella molecola uno e due doppi legami, il chè fa prendere il nome di "insaturi" a questi acidi e danno pregio al nostro ottimo grasso vegetale per le sue capacità antiossidanti (assieme ai polifenoli), oggi giustamente tanto valorizzate; per confronto, l'acido principale presente nel burro è il palmitico, che è invece un acido saturo (senza doppi legami, ved. sopra). Ma allora, tutto ciò premesso, l'olio è acido o non è acido, visto che (scusate il bisticcio di parole) gli acidi sono tutti esterificati e quindi non presenti fisicamente nel giallo e profumato liquido? |
|
Post n°81 pubblicato il 19 Febbraio 2011 da paoloalbert
No, gli esteri non sono coloro che vivono oltre confine... Nel post 56 s'era parlato di acidi (quelle sostanze che se fossero auto avrebbero tutte una targa con su scritto --> -COOH) Chiamiamo R- tutta la parte di molecola dell'acido che non sia -COOH
R-COOH + R'-OH --> R-COO-R' + H2O Quello che si è formato, R-CO-OR' è un estere! Naturalmente per far avvenire la reazione dobbiamo mettere in atto una procedura idonea al caso, per esempio con un catalizzatore acido (H+ sopra la freccia), giusta temperatura e tempo di reazione e tener presente che la reazione stessa è sempre di equilibrio, cioè la freccia non va esclusivamente verso destra ma a seconda delle condizioni di lavoro anche verso sinistra, creandosi un equilibrio fra reagenti e prodotti. Prendiamo per esempio due sostanze da tutti conosciute, l'acido acetico e l'alcol etilico, le cui formule ormai sono note: Ecco la reazione, messa senza il complesso meccanismo, proprio terra-terra: CH3-COOH + HO-CH2-CH3 <--> CH3-COO-CH2-CH3 + H2O Acido ed alcol si sono abbracciati ciascuno con la proprio parte "sensibile" (rispettivamente il carbossile e l'ossidrile), alla fine si è eliminata una molecola d'acqua (OH dall'acido + H dall'alcol = H2O) e si è formata una nuova sostanza di nome... acetato di etile! Anche nel nome il processo ricorda la salificazione.
Gli esteri sono diffusissimi in natura e quelli a pochi atomi di carbonio sono liquidi volatili dal caratteristico profumo, tant'è che vengono detti "esteri di frutta" per il loro piacevole aroma che per qualcuno di essi ricorda proprio l'odore di frutti maturi. |
|
Post n°80 pubblicato il 15 Febbraio 2011 da paoloalbert
Nel post n.56 avevo dedicato una puntata di queste mie riflessioni a quegli occasionali passanti ai quali non sarebbe dispiaciuto sentirsi dire senza tante complicazioni cosa sono gli acidi carbossilici. In principio era l'Idrocarburo... si potrebbe dire, e devo per forza partire da qui, facendomi scudo con mille sottintesi omissis... l'etano H3C-CH3 è un alcano; l'etilene H2C=CH2 è un alchene; l'acetilene H-C≡C-H è un alchino. Ora se da un idrocarburo eliminiamo un atomo di idrogeno e lo sostituiamo con un gruppo ossidrile -OH, otteniamo un'altra classe di composti, completamente diversa in tutto e per tutto dai genitori di origine: gli alcoli, che acquistano nel nome il suffisso "olo". CH3-H cioè il metano, dà origine a CH3-OH, l'alcool metilico o detto più propriamente metanolo. E se in un idrocarburo sostituiamo due idrogeni con due ossidrili? E' possibile questo? Certo! Ne derivano gli alcoli diossidrilici, triossidrolici... poliossidrilici, ognuno col suo bel nome e le sue interessanti proprietà. Ci sarebbero da aggiungere un'infinità di cose sugli alcoli, ma termino qui per non approffittare della pazienza dei volonterosi. |
|
Post n°79 pubblicato il 12 Febbraio 2011 da paoloalbert
Nel ragionamento sulle coppie del post 77 si parlava di solubilità (o meglio, insolubilità) dei sali, che è stato poi messo in pratica con la preparazione del bromato di bario nel post 78. Si potrebbe pensare che, per quanto restio a sciogliersi, un sale sarà sempre un pochino solubile... non è concepibile che non se ne sciolga nemmeno una molecola in un oceano d'acqua! Ma cosa succede se metto in acqua un sale "del tutto" insolubile? Il prodotto tra le concentrazioni ioniche [Cu++] e [S--] (le concentrazioni si indicano tra parentesi quadre) si chiama Prodotto di solubilità, si indica con Kps ed è una costante che dipende dalla sostanza in esame. Che senso ha un numero così piccolo? Per noi che siamo sperimentatori e vogliamo toccar con mano le cose, se buttiamo una spatolata di CuS in un litro d'acqua quanto se ne scioglierà, in pratica? Kps = [Cu2+][S2-] Kps = 6x10-37 Poichè una molecola di CuS dà origine ad uno ione Cu2+ ed uno solfuro S2- (in quantità identiche), ed il loro prodotto è 6x10-37, per sapere la concentrazione del CuS basterà estrarre (in questo caso) la radice quadrata del Kps, che vale 7,7x10-19 7,7x10-19 x 95 = 7,3x10-17 grammi sciolti in un litro Traducendo terra-terra con un po' di conversioni: per sciogliere completamente un milligrammo di solfuro di rame ci vuole qualcosa come tredici miliardi di metri cubi d'acqua...!!! C'era la sorpresa vero? Ma il CuS non è il più insolubile dei sali! Il solfuro di mercurio HgS (il cinabro) ha un pazzesco Kps di 2x10-53...!!! |
|
Post n°78 pubblicato il 07 Febbraio 2011 da paoloalbert
Per capire bene la preparazione di questo sale da parte dei non chimici, bisognerebbe leggere la storiella dell'altra volta, riguardo lo scambio di coppie. Per prepararlo ho usato prorio una reazione di metatesi, facendo scambiare tra di loro due metalli (bario e potassio) con altrettanti "radicali acidi" (cloruro e bromato). La reazione è la seguente: BaCl2 + 2 KBrO3 --> 2 KCl + Ba(BrO3)2 All'inizio abbiamo cloruro di bario e bromato di potassio; alla fine avremo cloruro di potassio e bromato di bario... un bello scambio di coppia! Procedura: - in un becker da 50 ml sciogliere 10 g KBrO3 in 21 ml di acqua bollente ed in un altro becker sciogliere 6,2 g BaCl2 in 8 ml di acqua bollente. Attenzione che l'acqua è in quantità proprio al limite della solubilità dei sali a 100°, pertanto i sali stessi non si scioglieranno completamente fino al raggiungimento del punto di ebollizione. Se del caso aggiungere qualche goccia d'acqua fino a soluzione limpida.
Il bromato di bario è un sale dalle interessanti proprietà ossidanti; si decompone per esempio volentieri sviluppando una bella fiamma verde, come quella che vediamo durante gli spettacoli pirotecnici, dei quali abbiamo già parlato.
|
|
Post n°77 pubblicato il 02 Febbraio 2011 da paoloalbert
Non fraintendiamo, si parla di coppie... chimiche! Allora torniamo alle nostre coppie umane, Aldo con Bruna, Carlo con Daria. Riassumendo: A+B- + C+D- (in acqua) --> A+ + B- + C+ + D- Ma cosa succede se un maschio ed una femmina (mettiamo che siano Carlo e Bruna) che prima non stavano insieme ed ora si trovano liberi di ballare al buio, hanno un terribile colpo di fulmine l'un l'altra? Riassumendo AB + CD --> AD + CB (e CB se ne vanno per conto loro) Si sono formate due nuove coppie per "doppio scambio", solo perchè i due nuovi partner CB sono fuggiti assieme! Esempio: avverrà la reazione tra cloruro di ferro e solfato di zinco per formare cloruro di zinco e solfato di ferro? FeCl2 + ZnSO4 --> FeSO4 + ZnCl2 ? Dobbiamo chiederci: si formarà un sale insolubile? Risposta: no, sia il cloruro di zinco che il solfato di ferro sono solubilissimi in acqua e rimangono disciolti sotto forma di ioni in equilibrio tra di loro. La reazione non avviene. Sostituiamo solo il ferro col calcio: cloruro di calcio e solfato di zinco formeranno cloruro di zinco e solfato di calcio? CaCl2 + ZnSO4 --> CaSO4 + ZnCl2 ? Siccome il solfato di calcio CaSO4 è insolubile, precipita (si dice così!) sul fondo del recipiente e si separa: la reazione di doppio scambio avviene, perchè la nuova coppia calcio/solfato è fuggita, lasciando da soli gli altri due! Sembra incredibile, ma questo semplice concetto di swapping tra le coppie rimane fonte di dubbio fino alla maturità ed oltre... |
 Il padre delle esterificazioni secondo questo metodo (ce ne sono altri!) è il grande chimico tedesco premio Nobel
Il padre delle esterificazioni secondo questo metodo (ce ne sono altri!) è il grande chimico tedesco premio Nobel 
Inviato da: paoloalbert
il 02/05/2021 alle 21:53
Inviato da: Bepi1249
il 15/04/2021 alle 14:11
Inviato da: Tanner85
il 06/02/2021 alle 00:01
Inviato da: poetryclub
il 04/10/2020 alle 23:00
Inviato da: poetryclub
il 04/10/2020 alle 20:58