Antiaritmici – La tormentata storia di Almarytm / Flecainide. Dall’approvazione in Italia nel 1986 allo studio CAST – Parte 1
Inizialmente la Flecainide / Almarytm aveva come indicazione principale il trattamento delle aritmie ventricolari
La Flecainide, un antiaritmico della classe IC, è stata sintetizzata nel corso di una ricerca sui composti fluorati della Procainamide da una piccola società farmaceutica americana, Riker, acquistata successivamente dalla 3M.
In Italia, l’approvazione di Flecainide, denominata in Italia Almarytm ( Tambocor nel resto del mondo ) avvenne nel maggio 1986, un anno dopo il previsto a causa di dati negativi ( alto numero di decessi ) dalla Germania.
L’antiaritmico, che agisce bloccando i canali del sodio, si era rivelato ben presto estremamente efficace nel sopprimere i battiti ectopici ventricoli ( BEV ). Ed è stata proprio questa sua caratteristica di BEV killer a proporlo come uno dei farmaci dello studio clinico CAST ( Cardiac Arrhythmias Suppression Trial) nella seconda metà degli anni ’80.
L’ipotesi perseguita dal CAST era di verificare se l’aritmia ventricolare fosse un fattore di rischio indipendente di morte dopo infarto miocardico
Lo studio fu interrotto nell’Aprile del 1989 dopo appena 10 mesi dall’inizio nel braccio Flecainide e nel braccio Encainde, un altro farmaco di classe IC, per una maggiore mortalità rispetto ai corrispettivi bracci placebo.
I risultati del CAST indussero le Autorità Sanitarie a limitare l’impiego della Flecainide nelle aritmie ventricolari. La Bristol Myers Squibb preferì ritirare dal mercato il proprio farmaco, l’Encainide.
Lo studio CAST fu criticato soprattutto perché la mortalità nei gruppi placebo era inferiore al preventivato, ma apparve chiaro che i farmaci antiaritmici di classe IC potevano diventare pericolosi nel trattamento delle aritmie ventricolari in pazienti con malattia ischemica.
Dagli studi clinici preliminari era emersa già la potenziale pericolosità di questo antiaritmico , soprattutto quando la Flecainide veniva somministrata al dosaggio di 400 mg/die e nei pazienti con cardiopatia ischemica e disfunzione ventricolare sinistra.
L’incidenza di effetti proaritmici con la Flecainide, cioè peggioramento dell’aritmia preesistente o insorgenza di nuova aritmia, era del 6,8% , di questi 2,3% erano le forme gravi e l’1% i casi fatali.
Studio CAST ( Versione Italiana )
Mortalità e morbilità nei pazienti trattati con Encainide, Flecainide o placebo: lo studio sulla soppressione dell’aritmia cardiaca
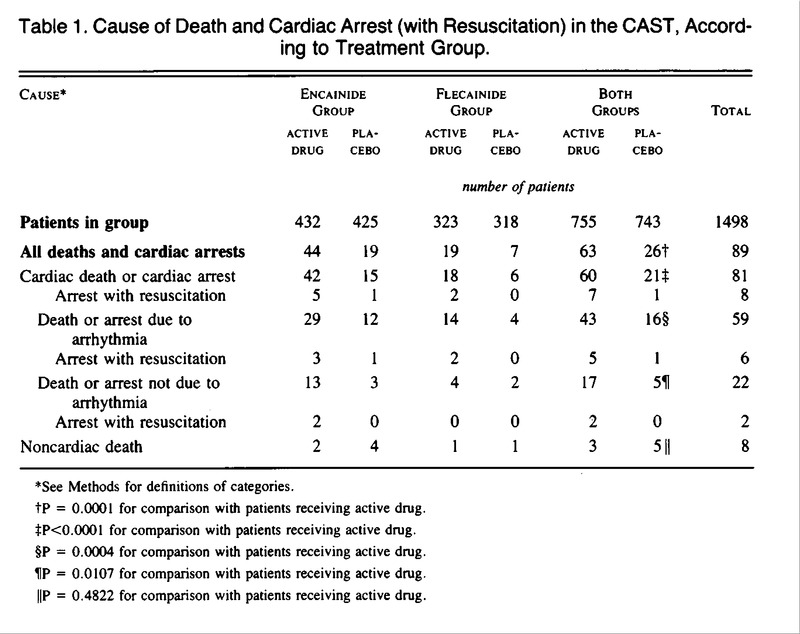
BACKGROUND E METODI – Nello studio CAST ( Cardiac Arrhythmia Suppression Trial ), progettato per testare l’ipotesi che la soppressione dell’ectopia ventricolare dopo un infarto del miocardio fosse in grado di ridurre l’incidenza di morte improvvisa, i pazienti in cui l’ectopia ventricolare poteva essere soppressa con Encainide, Flecainide o Moricizina sono stati assegnati in modo casuale ricevere il farmaco attivo o il placebo. L’uso di Encainide e Flecainide è stato interrotto a causa dell’eccesso di mortalità. E’ stata esaminata la mortalità e la morbilità dopo la randomizzazione a Encainide o Flecainide o al rispettivo placebo.
RISULTATI – Dei 1498 pazienti, 857 sono stati assegnati a ricevere Encainide o il suo placebo ( 432 al farmaco attivo e 425 al placebo ) e 641 sono stati assegnati a ricevere Flecainide o il suo placebo ( 323 al farmaco attivo e 318 al placebo ). Dopo un follow-up medio di 10 mesi, 89 pazienti erano deceduti: 59 per aritmia ( 43 trattati con farmaco vs. 16 trattati con placebo; P = 0,0004 ), 22 per cause cardiache non-aritmiche ( 17 trattati con farmaco vs. 5 trattati con placebo; P = 0,01 ) e 8 di cause non-cardiache ( 3 trattati con farmaci vs. 5 trattati con placebo ). Quasi tutte le morti cardiache non-dovute ad aritmia sono state attribuite a infarto miocardico acuto con shock ( 11 pazienti trattati con farmaco e 3 trattati con placebo ) o a insufficienza cardiaca congestizia cronica ( 4 trattati con farmaco e 2 trattati con placebo ). Non ci sono state differenze tra i pazienti che ricevevano il farmaco attivo e quelli che ricevevano il placebo nell’incidenza di tachicardia ventricolare non-letale, proaritmia, sincope, necessità di un pacemaker permanente, insufficienza cardiaca congestizia, infarto miocardico ricorrente, angina o necessità di bypass coronarico innesto o angioplastica.
CONCLUSIONI – C’è stato un eccesso di decessi per aritmia e decessi per shock dopo infarto miocardico acuto ricorrente nei pazienti trattati con Encainide o Flecainide. Gli eventi non-letali, tuttavia, sono stati equamente distribuiti tra i gruppi farmaco attivo e placebo. I meccanismi alla base dell’eccesso di mortalità durante il trattamento con Encainide o Flecainide rimangono sconosciuti. ( N Engl J Med 1991; 324:781–8 )
Studio CAST ( English Version )
Mortality and Morbidity in Patients Receiving Encainide, Flecainide, or Placebo — The Cardiac Arrhythmia Suppression Trial
BACKGROUND AND METHODS – In the Cardiac Arrhythmia Suppression Trial, designed to test the hypothesis that suppression of ventricular ectopy after a myocardial infarction reduces the incidence of sudden death, patients in whom ventricular ectopy could be suppressed with encainide, flecainide, or moricizine were randomly assigned to receive either active drug or placebo. The use of encainide and flecainide was discontinued because of excess mortality. We examined the mortality and morbidity after randomization to encainide or flecainide or their respective placebo.
RESULTS – Of 1498 patients, 857 were assigned to receive encainide or its placebo (432 to active drug and 425 to placebo) and 641 were assigned to receive flecainide or its placebo (323 to active drug and 318 to placebo). After a mean follow-up of 10 months, 89 patients had died: 59 of arrhythmia (43 receiving drug vs. 16 receiving placebo; P = 0.0004), 22 of nonarrhythmic cardiac causes (17 receiving drug vs. 5 receiving placebo; P = 0.01), and 8 of noncardiac causes (3 receiving drug vs. 5 receiving placebo). Almost all cardiac deaths not due to arrhythmia were attributed to acute myocardial infarction with shock (11 patients receiving drug and 3 receiving placebo) or to chronic congestive heart failure (4 receiving drug and 2 receiving placebo). There were no differences between the patients receiving active drug and those receiving placebo in the incidence of nonlethal disqualifying ventricular tachycardia, proarrhythmia, syncope, need for a permanent pacemaker, congestive heart failure, recurrent myocardial infarction, angina, or need for coronary-artery bypass grafting or angioplasty.
CONCLUSIONS – There was an excess of deaths due to arrhythmia and deaths due to shock after acute recurrent myocardial infarction in patients treated with encainide or flecainide. Nonlethal events, however, were equally distributed between the active-drug and placebo groups. The mechanisms underlying the excess mortality during treatment with encainide or flecainide remain unknown. ( N Engl J Med 1991; 324:781–8 )
XAGENA IN CARDIOLOGIA
AnginaOnline.net | Angiologia.net | Aritmie.net | Aritmologia.net | Cardiologia.net | CardiologiaOnline.it | CardiologiaOnline.net | Cuore.net | Dislipidemia.it | FibrillazioneAtriale.net | InfartoMiocardico.net | Ipertensione.net | ScompensoCardiaco.net |