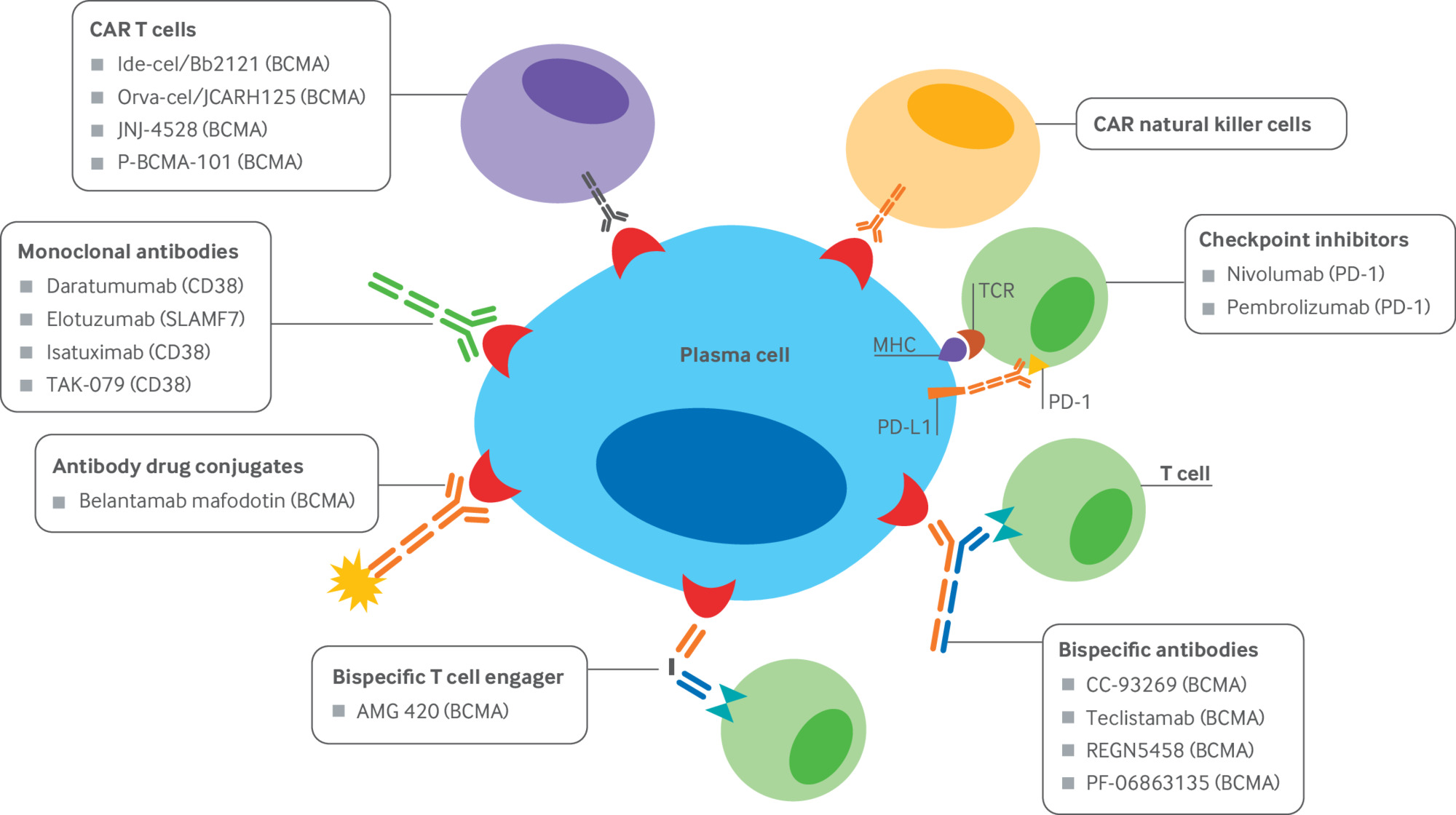
IMiD, Agenti immunomodulanti
Gli agenti IMiD ( ImmunoModulatory imide Drugs ) sono piccole molecole sviluppati da Celgene. Si tratta di composti disponibili per via orale per il trattamento di alcuni tumori ematologici.
Si ipotizza che gli agenti IMiD agiscano tramite meccanismi di azione multipli. Hanno dimostrato di aumentare l’attivazione e la proliferazione delle cellule T e la proliferazione della proteina IL-2 e l’attività delle cellule T CD8+ effettrici.
Gli agenti IMiD hanno dimostrato inoltre di influire sulla stimolazione e sull’espressione delle cellule Natural Killer ( NK ), agendo sia dall’interno dell’ambiente cellulare, per stimolare il sistema immunitario ad attaccare le cellule tumorali, sia attaccando direttamente queste ultime.
Oltre alle proprietà immunomodulanti, si ipotizza che gli agenti IMiD presentino un’attività antitumorale e antiangiogenica. Il portafoglio di agenti IMiD di Celgene è diventato un fattore fondamentale nella ricerca sul mieloma multiplo, con un numero sempre crescente di studi su questi composti come elementi di combinazione in diverse contestualizzazioni della malattia.
DAL TALIDOMIDE ALLA LENALIDOMIDE E ALLA POMALIDOMIDE
Il Talidomide, sviluppato dalla società tedesca Grünenthal, entrò sul mercato europeo alla fine degli anni ’50 come una sorta di farmaco miracoloso.
All’epoca, il Talidomide veniva prescritto come sedativo e come trattamento per l’asma, l’ipertensione e l’emicrania, tra le altre condizioni. È stato anche commercializzato nelle donne in gravidanza per curare la nausea mattutina.
Era considerato così sicuro che in Germania era disponibile senza prescrizione medica.
Ma solo pochi anni dopo è diventato chiaro che questo farmaco miracoloso era, in realtà, estremamente pericoloso. Si è scoperto che il Talidomide causa gravi difetti alla nascita. Migliaia di bambini sono nati in Europa con arti simili a pinne.
Il Talidomide fu ritirato dal mercato in Europa e altrove, e non è mai stato approvato per la vendita dalla Agenzia regolatoria FDA negli Stati Uniti.
Il farmaco è stato relegato per decenni nei libri di testo come un ammonimento sulla regolamentazione lassista dei farmaci, e non molto altro.
Poi, all’inizio degli anni ’90, i ricercatori che lavoravano sull’AIDS scoprirono che il Talidomide era in grado di potenziare una parte del sistema immunitario, sulla base di un precedente lavoro che aveva mostrato un ruolo del Talidomide nella lebbra.
Vedendo il potenziale commerciale, Celgene mostrò interesse per il Talidomide, brevettandolo con il nome di Thalomid Celgene.
Nel 1998 Celgene ottenne dalla FDA l’approvazione di Thalidomid come trattamento per la lebbra.
Alcuni anni dopo l’arrivo sul mercato di Thalomid, Celgene modificò la molecola togliendo un atomo di ossigeno e aggiungendo un atomo di azoto, creando un nuovo gruppo amminico. L’azienda chiamò il nuovo farmaco Revlimid, e il principio attivo Lenalidomide.
Nel 2006, Celgene fu abile ad espandere il mercato del Thalomid – e successivamente del Revlimid – ottenendo l’approvazione come “farmaco orfano” per promuoverlo come uno dei pochi farmaci in grado di rallentare il progresso del mieloma multiplo.
La designazione di farmaco orfano conferì alla società incentivi fiscali speciali e diritti esclusivi sul mercato per Thalomid per 7 anni.
ENGLISH VERSION
Thalomid is Celgene’s brand name for Thalidomide, which hit the market in Europe in the late 1950s as a sort of miracle drug.
Back then, Thalidomide was prescribed as a sedative and as a treatment for asthma, hypertension and migraines, among other conditions. It was also marketed to pregnant women to treat morning sickness. It was considered so safe that in Germany, it was available without a prescription.
But just a few years later it became clear this wonder drug was, in reality, wildly dangerous. It turned out to cause severe birth defects. Thousands of babies were born in Europe with flipper-like limbs.
Thalidomide was pulled off the market in Europe and elsewhere and was never approved for sale by the FDA in the United States. The drug was relegated for decades to textbooks as a cautionary tale about lax drug regulation and not much more.
Then, in the early 1990s, AIDS researchers found that Thalidomide boosted a part of the immune system, based on earlier work that suggested a role for Thalidomide in leprosy.
Seeing commercial potential, Celgene pulled Thalidomide out of the pharmaceutical dustbin and dubbed it Thalomid. It got approval from the FDA in 1998 as a treatment for leprosy.
A few years after Thalomid hit the market, Celgene altered it a bit by removing an oxygen atom and adding a nitrogen atom, creating a new amino group. The company called the new drug Revlimid ( Lenalidomide ).
In 2006, Celgene was able to expand the market for Thalomid — and later Revlimid — by winning “orphan drug” approval to sell it as one of the only drugs that could slow the progress of multiple myeloma. The orphan drug designation gave the company special tax incentives and exclusive rights to the market Thalomid for seven years. ( Source: NPR )
REVLIMID ( Lenalidomide )
Revlimid ha le seguenti indicazioni terapeutiche
a) Mieloma multiplo – Revlimid come monoterapia è indicato per la terapia di mantenimento dei pazienti adulti con mieloma multiplo di nuova diagnosi sottoposti a trapianto autologo di cellule staminali. Revlimid in regime terapeutico di associazione con Desametasone, o Bortezomib e Desametasone, o Melfalan e Prednisone è indicato per il trattamento dei pazienti adulti con
mieloma multiplo non precedentemente trattato che non sono eleggibili al trapianto. Revlimid, in associazione con Desametasone, è indicato per il trattamento dei pazienti adulti con mieloma multiplo sottoposti ad almeno una precedente terapia.
b) Sindromi mielodisplastiche – Revlimid come monoterapia è indicato per il trattamento dei pazienti adulti con anemia trasfusione-dipendente dovuta a sindromi mielodisplastiche ( MDS ) a rischio basso o intermedio-1, associate ad anomalia citogenetica da delezione isolata del 5q, quando altre opzioni terapeutiche sono insufficienti o inadeguate.
c) Linfoma mantellare – Revlimid come monoterapia è indicato per il trattamento dei pazienti adulti con linfoma mantellare recidivato o refrattario
d) Linfoma follicolare – Revlimid in associazione con Rituximab ( anticorpo anti-CD20 ) è indicato per il trattamento dei pazienti adulti con linfoma follicolare ( grado 1-3a ) precedentemente trattato.
IMNOVID ( Pomalidomide )
Imnovid ha le seguenti indicazioni terapeutiche
Mieloma multiplo
a) Imnovid, in associazione con Bortezomib e Desametasone, è indicato nel trattamento dei pazienti adulti con mieloma multiplo sottoposti ad almeno una precedente terapia comprendente Lenalidomide.
b) Imnovid, in associazione con Desametasone, è indicato nel trattamento dei pazienti adulti con mieloma multiplo recidivato e refrattario, sottoposti ad almeno due precedenti terapie, comprendenti sia Lenalidomide che Bortezomib, e con dimostrata progressione della malattia durante l’ultima terapia.
Celgene è stata acquistata da BMS nel 2019. Nel luglio 2022 BMS ha completato la fusione con Celgene. La fusione per incorporazione tra le due aziende ha dato vita a una tra la pipeline più ampie e diversificate nel mondo farmaceutico


Percorso di Formazione ECM e di aggiornamento scientifico in formato digitale condotto via Web